题目内容
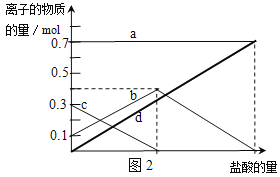
【题目】图表示可逆反应A(s)+B(g) n C(g);ΔH=Q kJ·mol1,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线。下列有关叙述中一定正确的
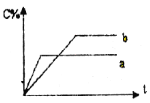
A. 若条件为催化剂,则a表示有催化剂,b表示没有催化剂
B. 只改变温度,则a比b的温度高,且Q>0
C. 只改变压强,则a比b的压强大,n>2
D. 由图象可以作出判断,反应一定从正反应方向开始
【答案】D
【解析】
A.加入催化剂同等程度增大正逆反应速率,平衡不移动,则a、b到达平衡时C的百分含量相同,故A错误;
B.a到达平衡时间短,则a温度高,升高温度,平衡时C的百分含量(C%)减小,平衡逆向移动,所以△H<0,即Q<0,故B错误;
C.a到达平衡时间短,则a压强高,压强越大,平衡时C的百分含量(C%)越小,则正反应为气体物质的量增大的反应,因为A是固体,所以n>1,故C错误;
D.C的百分含量从零开始逐渐增大,所以反应从正反应方向开始,故D正确;
故选D。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目