题目内容
5.H、N、O、P、Cr、Fe是元素周期表中六种常见元素.(1)P位于元素周期表第三周期第ⅤA族;Cr的基态原子价层电子排布式是3d54s1.O的一种18电子结构氢化物的电子式是
 .
.(2)用“>”“<”填空:
| 电负性 | 熔沸点 | 稳定性 | 酸性 |
| O>N | NH3>PH3 | Fe2+< Fe3+ | H3PO4<HNO3 |
(4)已知:
3Fe(s)+2O2(g)=Fe3O4(s)△H=-1118.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-438.6kJ/mol,
则3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g)的△H=-151.2KJ/mol.
分析 (1)根据P结构示意图为 结合主族元素周期数=电子层数、主族族序数=最外层电子数判断;Cr原子为24号元素,其满足半满和全满的稳定结构,据此书写其基态原子价层电子排布式;O的一种18电子结构氢化物为双氧水,双氧水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键,1个氧氧单键;
结合主族元素周期数=电子层数、主族族序数=最外层电子数判断;Cr原子为24号元素,其满足半满和全满的稳定结构,据此书写其基态原子价层电子排布式;O的一种18电子结构氢化物为双氧水,双氧水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键,1个氧氧单键;
(2)同周期从左到右元素的非金属性增强,电负性增强;物质的熔沸点与晶体类型有关,分子晶体中存在氢键的熔点大于没有氢键的;二价铁易被氧化成三价铁,所以三价铁比较稳定;元素的非金属性越强,其最高价氧化物的水化物的酸性越强;
(3)利用电解生成的Fe2+而将酸性含铬废水(K2Cr2O7)中的铬元素还原为三价,本身氧化成Fe3+,结合氧化还原反应电子得失守恒配平;
(4)①3Fe (s)+2O2(g)═Fe3O4(s)△H=-1118.4kJ•mol-1,
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol,
依据盖斯定律①-②×2书写热化学方程式,标注物质聚集状态和对应焓变.
解答 解:(1)磷为15号元素,其原子结构示意图为 ,又元素周期数=电子层数、主族族序数=最外层电子数,所以原子核外有3个电子层,处于第三周期,最外层电子数为5,处于ⅤA族;Cr原子为24号元素,其满足半满和全满的稳定结构,基态原子价层电子排布式为3d54s1;O的一种18电子结构氢化物为双氧水,双氧水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键,1个氧氧单键,双氧水的电子式为
,又元素周期数=电子层数、主族族序数=最外层电子数,所以原子核外有3个电子层,处于第三周期,最外层电子数为5,处于ⅤA族;Cr原子为24号元素,其满足半满和全满的稳定结构,基态原子价层电子排布式为3d54s1;O的一种18电子结构氢化物为双氧水,双氧水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键,1个氧氧单键,双氧水的电子式为 ,故答案为:三;ⅤA;3d54s1;
,故答案为:三;ⅤA;3d54s1; ;
;
(2)同周期从左到右元素的非金属性增强,电负性增强,所以电负性O>N;
物质的熔沸点与晶体类型有关,分子晶体中存在氢键的熔点大于没有氢键的,又氨气分子间存在氢键,所以熔沸点NH3>PH3;
因为二价铁易被氧化成三价铁,所以稳定性:Fe2+<Fe3+;
元素的非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性:P<N,所以酸性:H3PO4<HNO3;
故答案为:>;>;<;<;
(3)利用电解生成的Fe2+而将酸性含铬废水(K2Cr2O7)中的铬元素还原为三价,本身氧化成Fe3+,则离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)①3Fe (s)+2O2(g)═Fe3O4(s)△H=-1118.4kJ•mol-1,
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol,
依据盖斯定律①-②×2得到:3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-151.2KJ/mol;
故答案为:-151.2KJ/mol.
点评 本题考查了原子结构的推断及其性质的比较,铬及其化合物的性质、氧化还原反应,热化学方程式书写和盖斯定律计算应用,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| A. | X可能是金属铜 | B. | Y不可能是氢气 | C. | Z可能是氯化钠 | D. | Z可能是三氧化硫 |
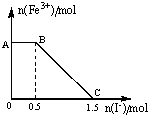 将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )
将一定量经硫酸酸化的KMnO4溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列有关说法不正确的是( )| A. | 图中AB段发生的是过量的酸性KMnO4溶液与KI的反应 | |
| B. | 从题中可以得出还原性:I->Fe2+>Mn2+ | |
| C. | 取B点以后的少量溶液滴入几滴KSCN溶液,溶液变红色 | |
| D. | 根据OC段的数据可知,开始加入的KMnO4的物质的量为0.5mol |
| A. | 1 L 1 mol•L-1的醋酸溶液中含有的醋酸分子数为NA | |
| B. | 电解精炼铜时,当阳极上质量减少6.4 g时,电路中转移的电子数为2NA | |
| C. | 常温下,46 g NO2和N2O4的混合物中含有的氧原子数为2NA | |
| D. | 11.2 L CO2中含有的分子数为0.5NA |
 ,D的核磁共振氢谱图中将出现4种峰;
,D的核磁共振氢谱图中将出现4种峰; ;
;
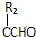
 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$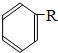 +HCl(R、R1、R2均为烃基)
+HCl(R、R1、R2均为烃基)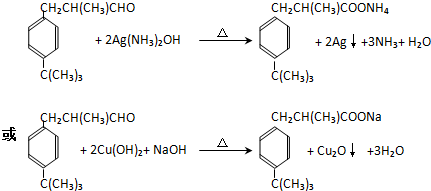 .
. .
.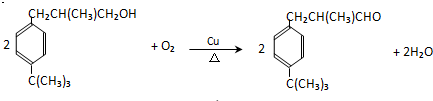 .
.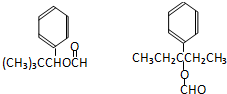 .
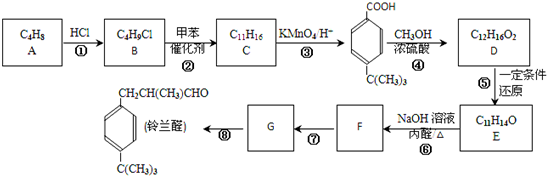
.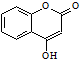 是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体.常用来制备抗凝血药,可通过下列路线合成:

 和乙醇为原料,制备
和乙醇为原料,制备  的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.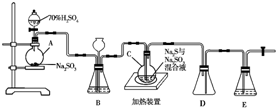 工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下:
工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程.烧瓶C中发生反应如下: $\stackrel{△}{→}$
$\stackrel{△}{→}$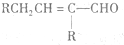 兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸
兔耳草醛是重要的合成香料,它具有独特的新鲜水果的清香.由枯茗酸 合成兔耳草醛的路线如下:
合成兔耳草醛的路线如下:
 、
、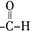 (写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热
(写结构式);检验B中含氧官能团的实验方案是配制银氨溶液,取少量B加入新配制的银氨溶液中,然后水浴加热 .
. 、
、 .
.