题目内容
14.下列变化中,必须加入氧化剂才能发生的是( )| A. | NaI→AgI | B. | CO2→CO | C. | Cl2→Ca(C1O)2 | D. | Na→NaOH |
分析 必须加入氧化剂才能发生,说明给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A.该反应中I元素化合价不变,发生复分解反应即可实现,故A错误;
B.该反应中C元素化合价由+4价变为+2价,所以二氧化碳作氧化剂,需要还原剂才能实现,如C等,故B错误;
C.该反应中Cl元素化合价由0价变为+1价,氯气作还原剂,氯气和氢氧化钙制取次氯酸钙时氯气既是氧化剂又是还原剂,不需要再加氧化剂,故C错误;
D.该反应中Na元素化合价由0价变为+1价,则钠作还原剂,需要氧化剂才能实现,故D正确;
故选D.
点评 本题考查氧化还原反应,明确元素化合价与物质性质关系是解本题关键,侧重考查基本概念,易错选项是C.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.把0.2mol/L NH4Cl溶液与0.1mol/L NaOH溶液等体积混合后溶液中下列微粒的物质的量浓度的关系正确的是( )
| A. | c(NH4+)=c(Na+)=c(OH-)>c(NH3•H2O) | B. | c(NH4+))=c(Na+)>c(NH3•H2O)>c(OH-) | ||
| C. | c(NH4+))>c(Na+)>c(OH-)>c(NH3•H2O) | D. | c(NH4+)>c(Na+)>c(NH3•H2O)>c(OH-) |
5.下列说法正确的是( )
| A. | SO2能使品红溶液褪色 | B. | S在O2中燃烧可生成SO3 | ||
| C. | 用澄清石灰水可鉴别CO2和SO2 | D. | 钠在氧气中燃烧生成氧化钠 |
2.下列关于反应热的说法正确的是( )
| A. | 当△H为“-”时,表示该反应为吸热反应 | |
| B. | 化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径和反应条件无关 | |
| C. | 已知C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ•mol-1,说明碳的燃烧热为110.5 kJ•mol-1 | |
| D. | 在25℃、1.01×105 Pa时,Ba(OH)2稀溶液与稀硫酸反应生成1 mol H2O放出的热量为57.3KJ |
9.下列物质露置于空气中不易变质的是( )
| A. | 氯水 | B. | 烧碱 | C. | 纯碱 | D. | 漂白粉 |
6.半导体生产的外延生长工序中,常需要控制掺杂,以保证控制电阻率,其中三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷与干燥的Cl2模拟工业生产制取PCl3,用图1装置制取Cl2,图2装置制取PCl3,部分仪器已省略.已知黄磷与少量Cl2反应生成PCl3.与过量Cl2反应生成PCl5、PCl3遇O2会生成POCl3、POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl.

请根据以上信息,回答下列问题:
(1)仪器乙的名称蒸馏烧瓶;
(2)冷凝管中的冷却水从a口进(填“a”或“b”);
(3)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)向仪器甲中通入干燥Cl2之前,应先通入一会干燥CO2,其目的是排尽甲装置中的空气,防止生成的PCl3与空气中的O2和H2O反应;
(5)碱石灰的作用是吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应;
(6)已知PCl5遇水发生强烈水解生成两种酸,写出PCl5与水反应的化学方程式PCl5+4H2O═5HCl+H3PO4;
(7)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到纯净的PCl3;
(8)测定产品中PCl3的质量分数:迅速称取ag产品,加水反应后配成250mL溶液,取出25.00mL加入过量的c1mol•L-1V1mL碘溶液,充分反应后再用c2mol•L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液.已知:H3PO3+H2O+I2=H3PO4+2H1:I2+2Na2S2O3=2Na1+Na2S4O6;假设测定过程中没有其他反应.根据上述数据:该产品中PC13的质量分数为$\frac{({c}_{1}{V}_{1}-\frac{1}{2}{C}_{2}{V}_{2})×1{0}^{-3}×137.5×10}{a}$×100%(用含字母的代数式表示).

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)仪器乙的名称蒸馏烧瓶;
(2)冷凝管中的冷却水从a口进(填“a”或“b”);
(3)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(4)向仪器甲中通入干燥Cl2之前,应先通入一会干燥CO2,其目的是排尽甲装置中的空气,防止生成的PCl3与空气中的O2和H2O反应;
(5)碱石灰的作用是吸收多余氯气防止污染空气,防止空气中的水蒸气进入烧瓶中与PCl3反应;
(6)已知PCl5遇水发生强烈水解生成两种酸,写出PCl5与水反应的化学方程式PCl5+4H2O═5HCl+H3PO4;
(7)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到纯净的PCl3;
(8)测定产品中PCl3的质量分数:迅速称取ag产品,加水反应后配成250mL溶液,取出25.00mL加入过量的c1mol•L-1V1mL碘溶液,充分反应后再用c2mol•L-1Na2S2O3溶液滴定过量的碘,终点时消耗V2mLNa2S2O3溶液.已知:H3PO3+H2O+I2=H3PO4+2H1:I2+2Na2S2O3=2Na1+Na2S4O6;假设测定过程中没有其他反应.根据上述数据:该产品中PC13的质量分数为$\frac{({c}_{1}{V}_{1}-\frac{1}{2}{C}_{2}{V}_{2})×1{0}^{-3}×137.5×10}{a}$×100%(用含字母的代数式表示).
7.下列反应产物不受反应条件不同而影响的是( )
| A. | 甲苯与溴蒸汽的反应 | B. | H2和Cl2反应 | ||
| C. | 乙烯与氧气的反应 | D. | 乙酸乙酯的水解 |
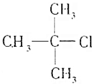 、④
、④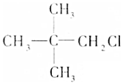 、⑤
、⑤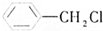 、⑥
、⑥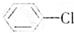 .
.