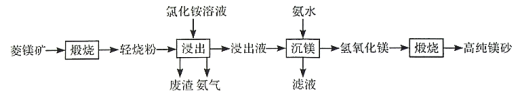
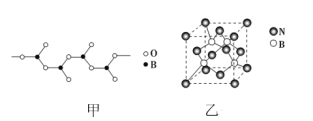
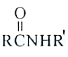题目内容
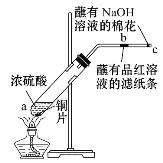
【题目】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。
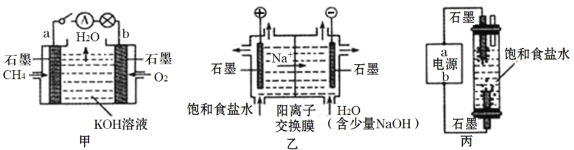
(1)甲装置中,a电极的反应式为_____。
(2)乙装置中,阴极区产物为_____。
(3)丙装置是一种家用84消毒液(NaClO)发生器。外接电源a为_____ (填“正”或“负”)极,该装置内发生反应的化学方程式为_____、_____。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为_____ (不考虑气体的溶解)。
(5)某工厂采用电解法处理含Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为Cr3+,Cr3在阴极区生成Cr(OH)3沉淀除去,工作原理如图。
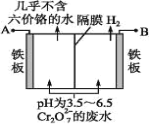
①写出电解时阴极的电极反应式____。
②写出Cr2O72-被还原为Cr3+的离子方程式____。
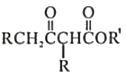
【答案】H2-2e-+2OH-=2H2O 氢氧化钠和氢气 负 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ Cl2+2NaOH=NaCl+NaClO+H2O 3:4 2H++2e-=H2↑ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
2NaOH+H2↑+Cl2↑ Cl2+2NaOH=NaCl+NaClO+H2O 3:4 2H++2e-=H2↑ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
【解析】
甲装置:该装置为氢氧燃料电池,氢气被氧化作负极,氧气被还原做作正极;
乙装置:该装置为电解池,与正极相连的一极为阳极发生氧化反应,与负极相连的为阴极发生还原反应;
丙装置:该装置为电解池,电解饱和食盐水时阳极产生氯气,阴极产生氢气和氢氧根,要制备次氯酸钠所以需要氯气到阴极与氢氧根反应,所以下端为阳极产生氯气;
(5)B电极生成氢气,说明该电极发生还原反应为阴极,氢离子放电生成氢气,导致阴极区pH变大;A电极为阳极,铁为电极材料,则铁被氧化生成Fe2+,继而将Cr2O72-还原成为Cr3+,然后迁移到阴极与OH-生成沉淀。
(1)甲装置是氢氧燃料电池,a电极通入氢气为负极,电解质溶液为KOH溶液,所以电极反应式为H2-2e-+2OH-=2H2O;
(2)乙装置是电解池,电解饱和食盐水,所以阴极区产物为氢氧化钠和氢气;
(3)根据分析可知该装置中发生电解饱和食盐水的反应,同时阳极产生的氯气与阴极产物发生反应制备次氯酸钠,下端为阳极,上端为阴极,即a电极为电源负极,该装置内发生反应的化学方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O;
2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O;
(4)若甲装置作为乙装置的电源,一段时间后,甲中总反应为:2H2+O2=2H2O;乙中总反应为:2NaCl+2H2O=2NaOH+H2↑+Cl2↑;各电极转移的电子相等,假如都是4mol,甲池消耗气体2mol+1mol=3mol,乙池产生气体2mol+2mol=4mol,物质的量之比为3:4;
(5)①阴极氢离子放电生成氢气,电极方程式为:2H++2e-=H2↑;
②根据分析可知反应过程中Fe2+将Cr2O72-还原成为Cr3+,方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。

【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:

(1)元素d基态原子包含____种运动状态不同的电子,这些电子位于____种能量不同的原子轨道中。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____。
(3)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____。
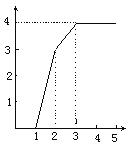
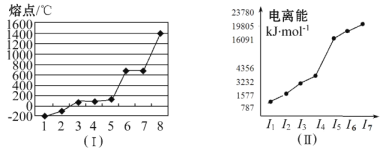
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是____(填I图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是_____(填元素名称)。
(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括____。