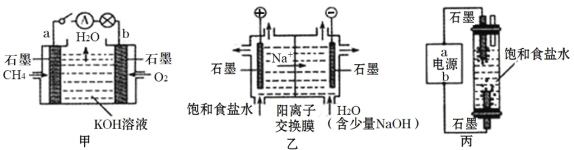
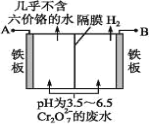
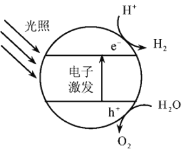
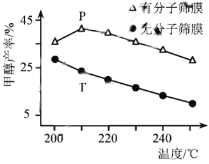
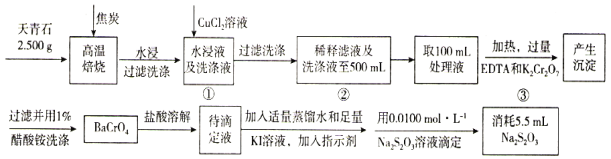
题目内容
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据________种不同的能级,其中有________个未成对电子。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ键的数目为________。
②C、N、O三种基态原子的第一电离能由大到小的顺序为________(用元素符号表示)。
③在相同的压强下,CO晶体的熔点高于N2晶体的原因为_______________________。
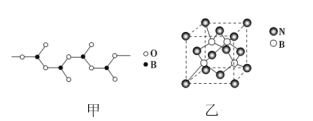
(3)BN晶体有多种结构,其中立方氮化硼具有金刚石型结构(如图乙)。
①晶体的最小环中含有________个B原子。
②若晶胞参数为anm,晶胞密度为ρg·cm-3,则阿伏加德罗常数的值可表示为________。
【答案】7 3 18NA(或18×6.02×1023等合理答案均可) N>O>C CO为极性分子,N2为非极性分子,CO分子间的范德华力更大 3 ![]()
【解析】
(1)基态Co原子核外电子排布式为1s22s22p63s23p63d74s2,原子核外电子占据1s、2s、2p、3s、3p、3d、4s,共7种不同的能级,其中有3个未成对电子。
故答案为:7;3 ;
(2)①1个CNO-中含有2个σ键,配位键也属于σ键,故1mol[Co(CNO)6]3-中含有σ键的数目为(2×6+6)×6.02×1023=18×6.02×1023;②等电子体是指价电子数和原子总数都相同的分子、离子或原子团,与CNO-互为等电子体的分子为CO2、CS2或N2O等;③同一周期元素从左到右第一电离能呈增大趋势,N原子中2p能级处于半充满稳定状态,第一电离能大于同周期相邻元素,C、N、O三种基态原子的第一电离能由大到小的顺序为N>O>C;④分子晶体熔点的高低取决于分子间作用力的大小,CO为极性分子而N2为非极性分子,故CO分子间作用力更大,即CO晶体的熔点高于N2晶体的熔点。
故答案为:18NA(或18×6.02×1023等合理答案均可); N>O>C; CO为极性分子,N2为非极性分子,CO分子间的范德华力更大;
(3)多硼酸根化学式为BO2-或(BO2)nn-,其中B原子形成3个σ键,杂化形式为sp2。
故答案为:3 ;
(4)①晶体的最小环中含有3个B原子和3个N原子,形成六元环。②立方氮化硼中,晶胞边长为anm,晶胞体积V=(anm)3,该晶胞中N原子个数=4、B原子个数为4,NA=![]() mol-1。
mol-1。
故答案为:![]() ;
;

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案