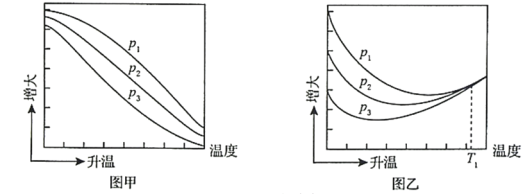
题目内容
【题目】某学生做浓硫酸性质的实验:
实验一:在一个白色的点滴板的孔穴中先分别加入小纸片、少量CuSO4·5H2O;然后再分别滴入几滴浓硫酸,观察现象。回答下列问题:
(1)浓硫酸滴入小纸片上,小纸片变__(填实验现象),说明浓硫酸具有__性。
(2)浓硫酸滴入CuSO4·5H2O中,胆矾__(填实验现象),说明浓硫酸具有__性。
实验二:按如图所示装置进行实验。玻璃管中放的是蘸有品红溶液的滤纸,玻璃管口处缠放蘸有NaOH溶液的棉花。给试管加热,观察现象,一段时间以后,停止加热。
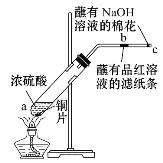
回答下列问题:
(3)写出a处反应的化学方程式:__。
(4)试管中的液体反应一段时间后,b处滤纸条的变化为__。
(5)写出C处NaOH的作__。有关的化学反应方程式为:__。
【答案】黑 脱水性 由蓝色变成白色 吸水性 Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 滤纸变白 吸收二氧化硫,防止污染环境 2NaOH+SO2= Na2SO3+H2O
CuSO4+SO2↑+2H2O 滤纸变白 吸收二氧化硫,防止污染环境 2NaOH+SO2= Na2SO3+H2O
【解析】
(1)浓硫酸具有脱水性,能够使纸片中的H、O元素脱出生成水;
(2)浓硫酸具有吸水性,可以将一些物质中的水给吸收;
(3)a中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(4)根据SO2的漂白性和酸性氧化物的性质进行解答;
(1)浓硫酸滴入小纸片上,小纸片变成黑色,体现了浓硫酸的脱水性,故答案为:黑;脱水性;
(2)浓硫酸滴入CuSO4![]() 5H2O中,胆矾中的水分会被浓硫酸吸出,胆矾由蓝色变成白色, 浓硫酸表现了吸水性;故答案为:由蓝色变成白色;吸水性;
5H2O中,胆矾中的水分会被浓硫酸吸出,胆矾由蓝色变成白色, 浓硫酸表现了吸水性;故答案为:由蓝色变成白色;吸水性;
(3)试管中,铜与浓硫酸在加热条件下能够反应生成二氧化硫、硫酸铜和水,反应的化学方程式为: Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O;故答案为: Cu+2H2SO4 (浓)
CuSO4+SO2↑+2H2O;故答案为: Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)铜与浓硫酸反应生成的二氧化硫具有漂白性,所以试管中的液体反应一段时间后,b处滤纸条变白,故答案为:滤纸变白;
(5)二氧化硫有毒,不能直接排放到大气中,由于NaOH溶液能够与二氧化硫反应生成无毒的Na2SO3,所以可以使用NaOH溶液吸收多余的二氧化硫,反应的化学方程式为:2NaOH+SO2=Na2SO3 +H2O,故答案为:吸收二氧化硫,防止污染环境;2NaOH+SO2= Na2SO3 +H2O。

【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(用元素符号或化学式回答下列问题)
(1)在这些元素中,化学性质最不活泼的是_______,其原子结构示意图是_________。
(2)用电子式表示元素④与⑦组成的化合物的形成过程:________,该化合物属于_______(填“共价”或“离子”)化合物。
(3)常温下呈液态的非金属单质是_______。
(4)表中能形成两性氢氧化物的元素是_________,该元素的单质与⑨的最高价氧化物的水化物反应的化学方程式是___________。
(5)①、⑥、⑦三种元素的最高价氧化物对应的水化物中,按酸性增强的顺序排列为_________。