题目内容
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
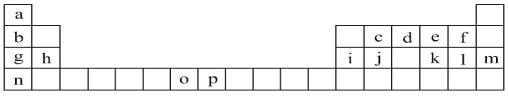
(1)元素d基态原子包含____种运动状态不同的电子,这些电子位于____种能量不同的原子轨道中。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____。
(3)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是_____。
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是____(填I图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是_____(填元素名称)。

(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括____。
【答案】7 3 基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量 Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;Fe2+为3d6,再失去一个电子后为半充满状态,因而相对易失去一个电子 2 硅 共价键
【解析】
(1)根据d在元素周期表中的位置可知d为N元素,N元素核外有7个电子,每个电子的运动状态均不同,所以有7种运动状态不同的电子,位于1s、2s、2p三种能量不同的原子轨道中;
(2)h为Mg元素,燃烧过程中放热,基态原子中电子获得能量跃迁到激发态,电子从能量较高的轨道跃迁到能力较低的轨道时,以光(子)的形式释放能量,所以发出耀眼白光;
(3)o为Mn,p为Fe;锰元素的原子电子排布式为1s22s22p63s23p63d54s2,Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;而铁的原子电子排布式为1s22s22p63s23p63d64s2,Fe2+为3d6,再失去一个电子后为半充满状态,因而相对易失去一个电子;
(4)同周期自左而右电负性增强,第三周期中Cl元素的电负性最大,氯气常温下为气体,比氩气的相对分子质量大,熔点仅高于氩气,故2代表氯元素;据图可知该元素的第四电离到第五电离能发生突变,说明其原子核外最外层有4个电子,则为第ⅣA族元素,周期表中所列的第IVA族元素j属于第三周期,所以为Si元素。
(5)a为H,d为N,l为Cl,可以形成离子化合物NH4Cl,除离子键外,铵根中还存在共价键(σ键和配位键)

 轻松课堂单元期中期末专题冲刺100分系列答案
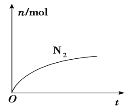
轻松课堂单元期中期末专题冲刺100分系列答案【题目】在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,—段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 10 | 12 |
n(Y)/mol | 1.40 | 1.10 | 0.40 | 0.40 |
下列说法正确的是
A. 反应前2 min 的平均速率v(Z)=3.0xl0-2 mol L-1min-1
B. 该温度下此反应的平衡常数K=64
C. 平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大
D. 反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)