题目内容
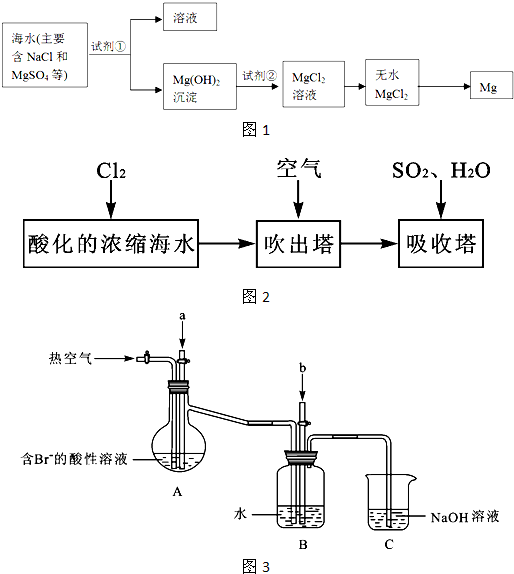
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:
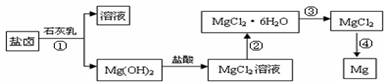
回答下列问题:
(1) 工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是
。
(2) 从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:
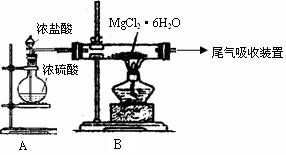
其中装置A的作用是 。
(4)写出过程④中发生反应的化学方程式 。
(1) 石灰乳原料丰富,成本低
(2) MgCl2(或氯化镁) 过滤 洗涤
(3)制备干燥的HCl气体
(4) MgCl2(熔融)![]() Mg +Cl2↑
Mg +Cl2↑
解析:
本题考查基本是要操作以及镁的提取。Ⅰ配制一定浓度的溶液时,俯视容量瓶的刻线,体积偏小,导致浓度偏大,③错误;瓷坩埚的主要成分为SiO2,能够与一些钠的化合物反应,如NaOH、Na2CO3等,所以应该用铁坩埚,④错误;分液时,上层液体从分液漏斗上口倒出,下层液体从下端放出,⑤错误;测溶液pH时,试纸不能湿润,否则溶液稀释,可能导致pH变化,⑥错误。
Ⅱ(1)从原料的来源和成本考虑;(2)因为Mg(OH)2比更Ca(OH)2难溶,发生反应Mg2++2OH-=Mg(OH)2↓;(3)利用浓盐酸的挥发性和浓硫酸的吸水性来制取干燥的HCl气体,从而保证装置B中的HCl气氛;(4)为电解熔融MgCl2的反应。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案