题目内容
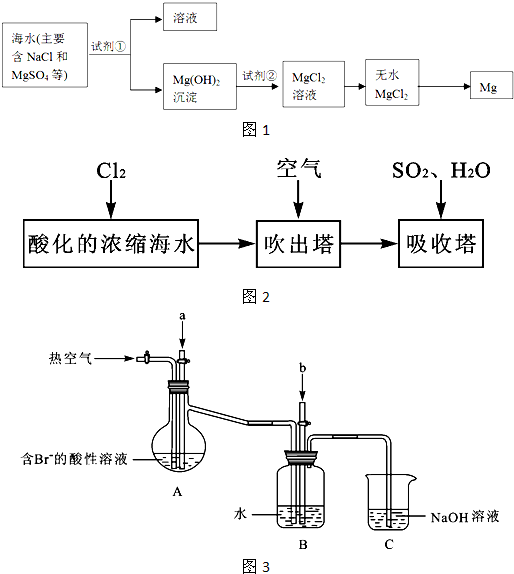
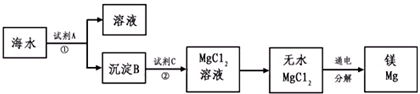
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.主要步骤如下:
试回答下列问题:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
(3)试剂②可以选用
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式
试回答下列问题:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用
Ca(OH)2
Ca(OH)2
,反应的离子方程式为Mg2++2OH-═Mg(OH)2↓
Mg2++2OH-═Mg(OH)2↓
;(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是
过滤
过滤
;(3)试剂②可以选用
HCl
HCl
;(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,写出该反应的化学方程式
MgCl2(熔融)
Mg+Cl2↑,
| ||
MgCl2(熔融)
Mg+Cl2↑,
.
| ||
分析:(1)可根据MgSO4转化为Mg(OH)2的关系分析;
(2)根据过滤分离不相溶的固体和液体;
(3)可根据Mg(OH)2转化为MgCl2的关系分析;
(4)根据题目信息来解答.
(2)根据过滤分离不相溶的固体和液体;
(3)可根据Mg(OH)2转化为MgCl2的关系分析;
(4)根据题目信息来解答.
解答:解:(1)MgSO4与Ca(OH)2反应生成了Mg(OH)2和CaSO4,方程式为:MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4,离子方程式:Mg2++2OH-═Mg(OH)2↓,
故答案为:Mg2++2OH-═Mg(OH)2↓;
(2)因Mg(OH)2沉淀不溶于水,可用过滤的方法分离,故答案为:过滤;
(3)Mg(OH)2与HCl反应生成了MgCl2和H2O,方程式为:Mg(OH)2+2HCl=MgCl2+H2O,故答案为:HCl;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑.
故答案为:Mg2++2OH-═Mg(OH)2↓;
(2)因Mg(OH)2沉淀不溶于水,可用过滤的方法分离,故答案为:过滤;
(3)Mg(OH)2与HCl反应生成了MgCl2和H2O,方程式为:Mg(OH)2+2HCl=MgCl2+H2O,故答案为:HCl;
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2:MgCl2(熔融)
| ||
| ||
点评:本题主要考查了从海水中提取镁的过程,难度不大,掌握提取的原理是解题的关键.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目