题目内容
【题目】下列物质在给定条件下能实现转化的是
①Si![]() Na2SiO3(aq)
Na2SiO3(aq)![]() H2SiO3
H2SiO3
②Na![]() Na2O2
Na2O2![]() NaOH
NaOH
③CaCO3![]() CaO
CaO![]() CaC2
CaC2![]() C2H4
C2H4
④饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
⑤MgCl2(aq)![]() MgCl2·6H2O
MgCl2·6H2O![]() Mg
Mg
⑥CuSO4(aq)![]() Cu(OH)2
Cu(OH)2![]() Cu2O
Cu2O
A. ①④⑥ B. ③④⑤
C. ②⑤⑥ D. ①②③
【答案】A
【解析】
硅与氢氧化钠溶液反应生成硅酸钠和氢气,硅酸钠与二氧化碳反应生成硅酸沉淀;Na与氧气常温反应生成氧化钠;向饱和食盐水中通入氨气,然后再通入CO2生成碳酸氢钠,碳酸氢钠分解生成碳酸钠;碳化钙与水反应生成乙炔;电解熔融氯化镁得到金属镁,电解六水氯化镁得不到金属镁;硫酸铜和过量氢氧化钠溶液反应生成氢氧化铜悬浊液,氢氧化铜悬浊液与葡萄糖加热发生氧化反应生成氧化亚铜红色沉淀。
硅与氢氧化钠溶液反应生成硅酸钠和氢气,硅酸钠与二氧化碳反应生成硅酸沉淀,①正确;Na与氧气常温反应生成氧化钠,加热生成过氧化钠,氧化钠与水反应生成氢氧化钠,②错误;碳酸钙高温煅烧生成氧化钙,氧化钙与C高温反应生成碳化钙,碳化钙与水反应生成乙炔,③错误;向饱和食盐水中通入氨气,然后再通入CO2生成碳酸氢钠,碳酸氢钠分解生成碳酸钠,④正确;氯化镁溶液蒸发结晶得到六水氯化镁晶体,六水氯化镁晶体在氯化氢的气流中加热得到氯化镁固体,电解熔融氯化镁得到金属镁,⑤错误;硫酸铜和过量氢氧化钠溶液反应生成氢氧化铜悬浊液,氢氧化铜悬浊液与葡萄糖加热发生氧化反应生成氧化亚铜红色沉淀,转化过程能实现,⑥正确。故选A。

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】许多非金属元素是重要的化工原料,某学习小组对某些非金属的化合物性质和制备进行如下实验探究:
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析
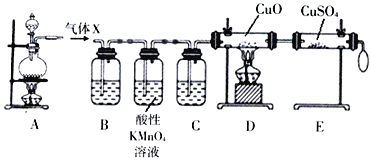
回答下列问题:
(1)气体X可能是________。(水蒸气除外)
(2)酸性高锰酸钾溶液的作用是________
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是____、______。
Ⅱ.下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及A中酒精灯已略)。
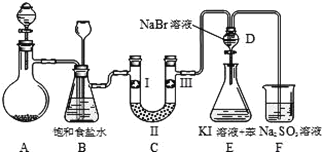
(1)实验室制氯气的离子方程式为________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如下表,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
A | ||
E |
(1)C在元素周期表中的位置为_______,其简单离子的结构示意图为____。
(2)AE2的化学式为_______。
(3)C、E、F的单质沸点最低的是__________(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___________________(填离子符号)。
(5)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________________。

