题目内容
【题目】许多非金属元素是重要的化工原料,某学习小组对某些非金属的化合物性质和制备进行如下实验探究:
Ⅰ.探究实验一:将一定量的浓H2SO4与足量Zn置于装置A中充分反应,对反应后的气体X进行气体成分分析
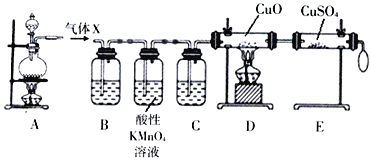
回答下列问题:
(1)气体X可能是________。(水蒸气除外)
(2)酸性高锰酸钾溶液的作用是________
(3)D、E装置用于证明气体X中的另一种组分,按照D、E装置顺序观察到的实验现象分别是____、______。
Ⅱ.下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备及A中酒精灯已略)。
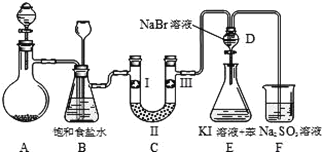
(1)实验室制氯气的离子方程式为________。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是_______(填编号)。
编号 | a | b | c | d |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
【答案】二氧化硫、氢气 除去气体中残余的二氧化硫 黑色粉末变红色 白色粉末变蓝色 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O d
【解析】
Ⅰ.(1)根据元素分析;
(2)根据二氧化硫的性质选择检验试剂;检验氢气之前需要除去二氧化硫;
(3)氢气与氧化铜反应生成铜单质和水,据此分析;
Ⅱ.在装置A中用高锰酸钾固体与浓盐酸反应制取Cl2;用装置B除去氯气中的杂质HCl,在装置C验证氯气是否具有漂白性,在装置D中验证Cl2与NaBr的反应,在装置E中验证KI是否发生反应,在装置F中用Na2SO3吸收尾气中的氧化性气体。
I.(1)将一定量的浓H2SO4与足量Zn置于装置A中充分反应,开始反应产生硫酸锌、二氧化硫和水;随着反应的进行,硫酸变为稀硫酸,这时Zn与稀硫酸反应产生硫酸锌和氢气,反应都是放热反应,因此生成的气体X中有水蒸气,还可能含有二氧化硫、氢气;
(2)装置B检验二氧化硫,二氧化硫具有漂白性、还原性,因此可以选择品红溶液、酸性高锰酸钾溶液(溴水)作为检验试剂;检验氢气的生成之前,应先排除二氧化硫的干扰,因此用酸性高锰酸钾除去气体中残余的二氧化硫;
(3) D、E装置用于证明气体X中的另一种组分,该组分是H2,在D装置中H2与CuO反应产生Cu单质和H2O,固体由黑色变为红色;产生的水蒸气进入E装置,与无水硫酸铜反应变为硫酸铜晶体,固体的颜色由白色变为蓝色,所以D、E装置观察到的实验现象分别是黑色粉末变红色、白色粉末变蓝色;
II. (1)实验室也可用KMnO4与浓盐酸混合发生氧化还原反应制取氯气,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)装置C的实验目的是验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,根据图示装置可知,II中应该为固体干燥剂,氯气干燥后再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,故合理选项是d。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案