题目内容
【题目】E的产量是衡量一个国家石油化工水平发展的标志,F为高分子化合物,能进行如图所示的反应. 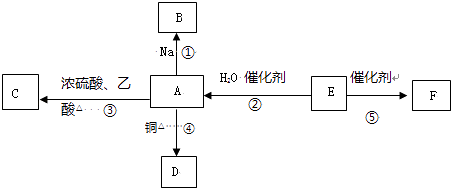
(1)请写出E的电子式 .
(2)下列反应的化学方程式:(要求有机物必须写结构简式) 反应②: 反应类型 .
反应④:反应类型 .
反应⑤:反应类型 .
(3)比较反应①剧烈程度(填>、=或<)钠和水反应的烈程度.
【答案】
(1)![]()
(2)CH2=CH2+H2O ![]() ?CH3CH2OH;加成反应;2 CH3CH2OH+O2
?CH3CH2OH;加成反应;2 CH3CH2OH+O2![]() ?2 CH3CHO+2H2O;氧化反应; nCH2=CH2
?2 CH3CHO+2H2O;氧化反应; nCH2=CH2![]()
![]() ;加聚反应
;加聚反应
(3)<
【解析】解:E的产量是衡量一个国家石油化工水平发展的标志,则E是CH2=CH2,乙烯和水发生加成反应生成A,A为CH3CH2OH,F为高分子化合物,则F为聚乙烯,结构简式为 ![]() ;
;
A和钠反应生成B,B为CH3CH2ONa,A在Cu作催化剂条件下加热生成D,D为CH3CHO,A和乙酸在浓硫酸作催化剂、加热条件下发生酯化反应生成C,C为CH3COOCH2CH3;(1)通过以上分析知,E是乙烯,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(2)反应②:CH2=CH2+H2O
;(2)反应②:CH2=CH2+H2O ![]() CH3CH2OH,反应类型是加成反应;
CH3CH2OH,反应类型是加成反应;
反应④:2 CH3CH2OH+O2 ![]() 2 CH3CHO+2H2O,反应类型是氧化反应;
2 CH3CHO+2H2O,反应类型是氧化反应;
反应⑤:nCH2=CH2 ![]()
![]() ,反应类型加聚反应,
,反应类型加聚反应,
所以答案是:CH2=CH2+H2O ![]() CH3CH2OH;加成反应;
CH3CH2OH;加成反应;
2 CH3CH2OH+O2 ![]() 2 CH3CHO+2H2O;氧化反应;
2 CH3CHO+2H2O;氧化反应;
nCH2=CH2 ![]()
![]() ;加聚反应;(3)水和Na反应比乙醇和钠反应剧烈,所以答案是:<.
;加聚反应;(3)水和Na反应比乙醇和钠反应剧烈,所以答案是:<.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目




