题目内容
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是

A. 洗气瓶中产生的沉淀是碳酸钡
B. 从Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是碳酸钡和硫酸钡的混合物
D. Z导管口有红棕色气体出现
【答案】D
【解析】C与浓硫酸共热反应生成CO2、SO2和H2O,产生的气体X中含CO2、SO2;Cu与浓HNO3反应生成Cu(NO3)2、NO2和H2O,气体Y中含NO2;将X、Y同时通入足量BaCl2溶液中,发生的反应有3NO2+H2O=2HNO3+NO、3SO2+2HNO3+2H2O=3H2SO4+2NO、H2SO4+BaCl2=BaSO4↓+2HCl。
C与浓硫酸共热反应生成CO2、SO2和H2O,产生的气体X中含CO2、SO2;Cu与浓HNO3反应生成Cu(NO3)2、NO2和H2O,气体Y中含NO2;将X、Y同时通入足量BaCl2溶液中,发生的反应有3NO2+H2O=2HNO3+NO、3SO2+2HNO3+2H2O=3H2SO4+2NO、H2SO4+BaCl2=BaSO4↓+2HCl。A项,根据上述分析,洗气瓶中产生的沉淀是BaSO4,CO2与BaCl2溶液不反应,A项错误;B项,CO2不能被BaCl2溶液吸收,从Z导管出来的气体中含CO2,B项错误;C项,洗气瓶中的沉淀为BaSO4,C项错误;D项,反应中有NO生成,在Z导管口NO遇空气中氧气变为红棕色的NO2气体,D项正确;答案选D。

【题目】沉淀转化广泛应用于工业生产和科学实验。为了探究AgCl、Ag2S(黑色)的溶解性及转化等相关性质,做以下实验:
步 骤 | 现 象 |
Ⅰ.将NaCl溶液滴入AgNO3溶液中至恰好完全反应。 | 产生白色沉淀。 |
Ⅱ.过滤出Ⅰ中的白色沉淀置于试管中,在试管中加入过量Na2S溶液并充分振荡。 | 白色沉淀变为黑色。 |
Ⅲ.过滤出Ⅱ中的黑色沉淀置于试管中,在试管中加入过量的NaCl溶液并充分振荡后静置。 | 沉淀由黑色最后完全变为乳白色。 |
回答下列问题:
(1)Ⅰ中的白色沉淀是__________。
(2)写出Ⅱ中沉淀变黑的离子方程式__________ ,沉淀转化的主要原因是______________。
(3)滤出步骤Ⅲ中的乳白色沉淀,加入过量的浓HNO3使之充分反应,有红棕色气体生成,尚有部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀;
ⅱ.将Y与足量的KI溶液充分混合,白色沉淀最终转化为黄色沉淀。
① 由ⅰ判断,滤液X中被检出的离子是_______。
② 由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有__________和__________。
(4)为了证明实验步骤Ⅲ中的黑色沉淀只有在NaCl存在下,才能和氧气反应转化为乳白色沉淀,设计了如下对照实验并将实验结果记录在右侧的表格中。
装置 | 实验结果 |
B | 一段时间后,出现乳白色沉淀 |
C | 一段时间后,无明显变化 |
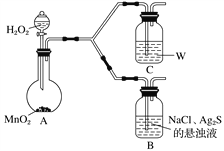
①A中,盛有MnO2的玻璃仪器名称是_________________。
②C中盛放的是物质W的悬浊液,W是________(填化学式)。
③请完成B中发生反应的反应式并配平:_____
Ag2S+ + + H2O![]() AgCl+ + NaOH
AgCl+ + NaOH
________
【题目】氢气是21世纪的新型能源.制氢的方法之一是以煤的转化为基础,部分反应如下: CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1
CaO(s)+CO2(g)CaCO3(s)△H=﹣172kJmol﹣1
CO2(g)+4H2(g)CH4(g)+2H2O(g)△H=﹣187kJmol﹣1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式 .
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)CH4(g)+2H2O(g)和CaO(s)+CO2(g)CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
物质 | CO2 | H2 | CaO |
0 | 0.50 | 1.00 | 0.40 |
2 | 0.35 | 0.60 | a |
6 | 0.20 | 0.20 | b |
8 | 0.20 | 0.20 | b |
①反应在0~2min内的平均反应速率v(H2)=
②b=
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2 , CaCO3质量减小 D.充入少量CO2 , c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)CH4(g)+2H2O(g)的化学平衡常数K= . 若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2molL﹣1 NaOH溶液中,下列说法正确的是
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32﹣)>c(OH﹣ )>c(HCO3﹣)>c(H+)
D.c(OH﹣)=2c(H2CO3)+c(HCO3﹣ )+c(H+ )