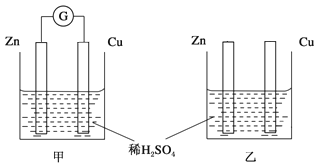
题目内容
【题目】阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,11.2 L四氯化碳中含有的共价键数为2NA
B. 20g T218O分子中含有的中子数为10N A
C. 0.1 mol NO与O2的混合气体中,所含原子总数为0.2 NA
D. 0.1 mol KI与0.1 mol FeCl3在溶液中反应,转移的电子数为0.1 NA
【答案】C
【解析】A项,CCl4在标准状况下呈液态,无法用22.4L/mol计算CCl4物质的量;B项,T218O的摩尔质量为24g/mol,1个T218O分子中含14个中子;C项,根据原子守恒作答;D项,KI与FeCl3的反应为2I-+2Fe3+![]() I2+2Fe2+,该反应为可逆反应。
I2+2Fe2+,该反应为可逆反应。
A项,CCl4在标准状况下呈液态,无法用22.4L/mol计算CCl4物质的量,A项错误;B项,T218O的摩尔质量为24g/mol,n(T218O)=![]() =
=![]() mol,1个T218O分子中含14个中子,20gT218O中含有中子物质的量为
mol,1个T218O分子中含14个中子,20gT218O中含有中子物质的量为![]() mol
mol![]() 14=
14=![]() mol,B项错误;C项,NO与O2都是双原子分子,根据原子守恒,0.1molNO与O2的混合气体中所含原子物质的量为0.2mol,C项正确;D项,KI与FeCl3的反应为2I-+2Fe3+
mol,B项错误;C项,NO与O2都是双原子分子,根据原子守恒,0.1molNO与O2的混合气体中所含原子物质的量为0.2mol,C项正确;D项,KI与FeCl3的反应为2I-+2Fe3+![]() I2+2Fe2+,该反应为可逆反应,0.1molKI与0.1molFeCl3的反应中转移电子物质的量小于0.1mol,D项错误;答案选C。
I2+2Fe2+,该反应为可逆反应,0.1molKI与0.1molFeCl3的反应中转移电子物质的量小于0.1mol,D项错误;答案选C。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案【题目】沉淀转化广泛应用于工业生产和科学实验。为了探究AgCl、Ag2S(黑色)的溶解性及转化等相关性质,做以下实验:
步 骤 | 现 象 |
Ⅰ.将NaCl溶液滴入AgNO3溶液中至恰好完全反应。 | 产生白色沉淀。 |
Ⅱ.过滤出Ⅰ中的白色沉淀置于试管中,在试管中加入过量Na2S溶液并充分振荡。 | 白色沉淀变为黑色。 |
Ⅲ.过滤出Ⅱ中的黑色沉淀置于试管中,在试管中加入过量的NaCl溶液并充分振荡后静置。 | 沉淀由黑色最后完全变为乳白色。 |
回答下列问题:
(1)Ⅰ中的白色沉淀是__________。
(2)写出Ⅱ中沉淀变黑的离子方程式__________ ,沉淀转化的主要原因是______________。
(3)滤出步骤Ⅲ中的乳白色沉淀,加入过量的浓HNO3使之充分反应,有红棕色气体生成,尚有部分沉淀未溶解,过滤得到滤液X和白色沉淀Y。
ⅰ.向X中滴加Ba(NO3)2溶液,产生白色沉淀;
ⅱ.将Y与足量的KI溶液充分混合,白色沉淀最终转化为黄色沉淀。
① 由ⅰ判断,滤液X中被检出的离子是_______。
② 由ⅰ、ⅱ可确认步骤Ⅲ中乳白色沉淀含有__________和__________。
(4)为了证明实验步骤Ⅲ中的黑色沉淀只有在NaCl存在下,才能和氧气反应转化为乳白色沉淀,设计了如下对照实验并将实验结果记录在右侧的表格中。
装置 | 实验结果 |
B | 一段时间后,出现乳白色沉淀 |
C | 一段时间后,无明显变化 |
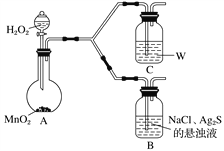
①A中,盛有MnO2的玻璃仪器名称是_________________。
②C中盛放的是物质W的悬浊液,W是________(填化学式)。
③请完成B中发生反应的反应式并配平:_____
Ag2S+ + + H2O![]() AgCl+ + NaOH
AgCl+ + NaOH
________