题目内容
【题目】现有三组混合物:①CCl4 和水 ②45%的酒精水溶液 ③碘水,欲分离各组混合物,采用的主要方法依次是( )
A.溶解、过滤 、结晶B.分液、蒸馏、萃取
C.萃取、分液、蒸馏D.蒸馏、分液、萃取
【答案】B
【解析】
①CCl4 和水:二者液液不容,分层,采用分液进行分离;②45%的酒精水溶液:乙醇与水互溶,二者沸点相差小于三十度,若直接蒸馏分离出来的乙醇含有少量水,应加入氧化钙后进行蒸馏;③碘水:碘单质可以溶于水,但是溶解度不大,在苯或者四氯化碳中的溶解度很大,同时三者不发生化学反应,因此可以采用萃取进行分离。答案选B。

【题目】氢气是21世纪的新型能源.制氢的方法之一是以煤的转化为基础,部分反应如下: CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1
CaO(s)+CO2(g)CaCO3(s)△H=﹣172kJmol﹣1
CO2(g)+4H2(g)CH4(g)+2H2O(g)△H=﹣187kJmol﹣1
(1)写出CO与H2生成CH4和水蒸气的热化学方程式 .
(2)某温度下,在10L密闭容器中投入CO2、H2和CaO,仅发生CO2(g)+4H2(g)CH4(g)+2H2O(g)和CaO(s)+CO2(g)CaCO3(s)两个反应,部分物质的物质的量与时间的关系如表所示:
物质 | CO2 | H2 | CaO |
0 | 0.50 | 1.00 | 0.40 |
2 | 0.35 | 0.60 | a |
6 | 0.20 | 0.20 | b |
8 | 0.20 | 0.20 | b |
①反应在0~2min内的平均反应速率v(H2)=
②b=
③反应到达平衡后,改变反应的某些条件,再次达到平衡时,不正确的是(填字母)
A.扩大容器体积c(H2)增大 B.升高温度,n(CO2)增大
C.充入少量H2 , CaCO3质量减小 D.充入少量CO2 , c(CH4)增大
④此温度下,反应CO2(g)+4H2(g)CH4(g)+2H2O(g)的化学平衡常数K= . 若向10L容器中投入CO2、H2和CH4各0.1mol,H2O(g)xmol,要使v正(CO2)>v逆(CO2),x的取值范围为
(3)若以CH4、O2组成燃料电池,在酸性条件下负极电极反应式为.当两极消耗3.36L气体(标准状况)时,将产生的气体(假设全部逸出)通入50mL2molL﹣1 NaOH溶液中,下列说法正确的是
A.反应过程中共转移电子1.2mol
B.所得溶液为Na2CO3和NaHCO3的混合溶液
C.c(Na+ )>c(CO32﹣)>c(OH﹣ )>c(HCO3﹣)>c(H+)
D.c(OH﹣)=2c(H2CO3)+c(HCO3﹣ )+c(H+ )
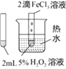
【题目】下列图中的实验方案,能达到实验目的的是:( )
A | B | C | D | |
实验方案 |
|
|
|
|
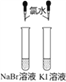
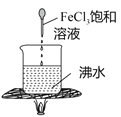
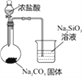
实验目的 | 验证FeCl3对H2O2分解反应有催化作用 | 验证单质氧化性: Cl2>Br2>I2 | 加热至混合液呈红褐色,停止加热,制备Fe(OH)3胶体 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D