题目内容
8.镓、铝为同族元素,性质相似,现将一块镓铝合金完全溶于烧碱溶液中得到溶液X.已知:| Al(OH)3 | Ga(OH)3 | |
| 酸式电离常数Ka | 2×10-11 | 1×10-7 |
| 碱式电离常数Kb | 1.3×10-33 | 1.4×10-34 |
②镓与烧碱溶液反应的离子方程式是2Ga+2H2O+2OH-=2GaO2-+3H2↑;
③往X溶液中缓缓通入CO2,最先析出的氢氧化物是Al(OH)3.
分析 ①氢氧化镓与氢氧化铝的性质相似,结合氢氧化铝的电离书写;
②Ga、Al是同一主族元素,二者性质相似,根据Al和烧碱溶液反应离子方程式书写;
③所得的溶液中存在平衡:H++H2O+GaO2-?Ga(OH)3,H++H2O+AlO2-?Al(OH)3,电离平衡常数越小,越容易析出得到沉淀.
解答 解:①氢氧化镓与氢氧化铝的性质相似,氢氧化镓的电离方程式为:H++H2O+GaO2-?Ga(OH)3?Ga3++3OH-,
故答案为:H++H2O+GaO2-?Ga(OH)3?Ga3++3OH-;
②Ga、Al是同一主族元素,二者性质相似,根据Al和烧碱溶液反应离子方程式书写Ga和NaOH反应离子方程式为2Ga+2H2O+2OH-=2GaO2-+3H2↑,故答案为:2Ga+2H2O+2OH-=2GaO2-+3H2↑;
③所得的溶液中存在平衡:H++H2O+GaO2-?Ga(OH)3,H++H2O+AlO2-?Al(OH)3,Al(OH)3的电离平衡常数更小,故溶液中通入二氧化碳,先析出Al(OH)3沉淀,
故答案为:Al(OH)3.
点评 本题考查元素周期律,为高频考点,明确同一主族元素性质相似性及递变性是解本题关键,注意知识迁移方法的灵活运用,题目难度不大.

练习册系列答案
相关题目
19.某一元醛发生银镜反应,生成金属银4.32g,等量该醛完全燃烧后,可生成水1.08g,则此醛可以是下列中的( )
| A. | 丙醛(CH3CH2CHO) | B. | 丙烯醛(CH2=CH-CHO) | ||
| C. | 丁醛(C3H7CHO) | D. | 丁烯醛(CH3-CH=CH-CHO) |
3.X、Y是浓度均为0.1mol/L的溶液中的某一种:①混有少量盐酸的MgSO4溶液 ②Al2(SO4)3溶液 ③明矾溶液 ④Ba(OH)2溶液 ⑤NaOH溶液.现向溶液X中逐滴加入溶液Y.得到的沉淀量与所加Y溶液的体积的关系的部分图象如图所示.则符合该图象的X、Y的组合共有( )

| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
20.下列反应的离子方程式书写正确的是( )
| A. | 向NaOH溶液中通入少量CO2:OH-+CO2═HCO3- | |
| B. | 用氨水吸收少量SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| C. | Al(NO3)2溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+2H2O+4NH4+ | |
| D. | 向Fe2(SO4)3的酸性溶液中通入足量H2S:Fe3++H2S═Fe2++S↓+2H+ |
17.在0℃,101kPa下,下列有关N2,O2,CH4 3种气体的叙述正确的是( )
| A. | 其密度之比等于物质的量之比 | |
| B. | 其密度之比等于摩尔质量之比 | |
| C. | 等质量的3种气体,其体积之比等于相对分子质量之比 | |
| D. | 等体积的3种气体,其物质的量之比等于相对分子质量之比 |
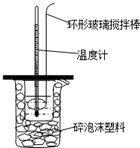 用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
 .
. 安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善.已知SO2可以用Fe( NO3)3溶液吸收,0.1mol/L的Fe(NO3)3溶液的pH=2某学习小组据此展开如下相关探究:
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善.已知SO2可以用Fe( NO3)3溶液吸收,0.1mol/L的Fe(NO3)3溶液的pH=2某学习小组据此展开如下相关探究: