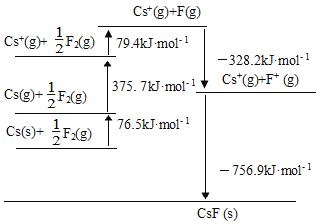
题目内容
【题目】为研究 NH3的某种性质并测定其组成,某小组课外活动欲利用 CuO 与 NH3 反应,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
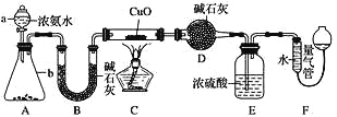
(1)仪器 D 的名称为 _____________。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 _____________性,写出相应的化学方程式 ____________。
(3)E 装置中浓硫酸的作用 ____________。
(4)读取气体体积前,应对装置 F 进行的操作:_____________。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 _____________。
A.Na2SO3 溶液与 HNO3 B.铜与浓 H2SO4
C.碳与浓 H2SO4 D.Na2SO3 固体与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 _______________________,表明 SO2 的氧化性比 I2________(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________(填化学式)。
【答案】球形干燥管 还原 2NH3 + 3CuO ![]() 3Cu + N2 + 3H2O 防止F中的水分进入D装置,并吸收未反应的氨气 调整F装置,使两边液面相平
3Cu + N2 + 3H2O 防止F中的水分进入D装置,并吸收未反应的氨气 调整F装置,使两边液面相平 ![]() D 无明显现象或溶液不变蓝 弱 Na2SO3和NaHSO3
D 无明显现象或溶液不变蓝 弱 Na2SO3和NaHSO3
【解析】
实验室一般用浓氨水和氧化钙反应生成氨气,用碱石灰干燥氨气,再通入到氧化铜中生成铜、氮气和水,用碱石灰干燥,再用浓硫酸吸收未反应的氨气,用量气管测定生成的氮气的体积时,使用量气管读数之前要冷却至室温,将两端液面相平。
(1)仪器D的名称为球形干燥管;故答案为:球形干燥管。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,说明氧化铜变为铜,化合价降低,氨气反应生成氮气,化合价升高,因此上述现象证明NH3 具有还原性,相应的化学方程式2NH3 + 3CuO![]() 3Cu + N2 + 3H2O;故答案为:还原;2NH3 + 3CuO
3Cu + N2 + 3H2O;故答案为:还原;2NH3 + 3CuO![]() 3Cu + N2 + 3H2O。
3Cu + N2 + 3H2O。
(3)C装置中氨气与氧化铜反应,部分未反应完的氨气进入到后续装置,因此E装置中浓硫酸的作用防止F中的水分进入D装置,并吸收未反应的氨气;故答案为:防止F中的水分进入D装置,并吸收未反应的氨气。
(4)读取气体体积前,装置两端的液面应该相平,因此应对装置F进行的操作:调整F装置,使两边液面相平;故答案为:调整F装置,使两边液面相平。
(5)实验完毕,若测得干燥管 D增重mg即为水的质量,物质的量为![]() ,装置F测得气体的体积为nL(已折算成标准状况),则氮气的物质的量
,装置F测得气体的体积为nL(已折算成标准状况),则氮气的物质的量![]() ,根据元素守恒,则氨分子中氮、氢的原子个数比为
,根据元素守恒,则氨分子中氮、氢的原子个数比为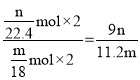 ;故答案为:
;故答案为:![]() 。
。
(6)①A.Na2SO3 溶液与 HNO3发生氧化还原反应,不会生成SO2 气体,故A不符合题意;
B.铜与浓 H2SO4在加热条件下才发生反应,故B不符合题意;
C.碳与浓 H2SO4加热才反应,故C不符合题意;
D.Na2SO3 固体与浓H2SO4反应生成SO2 气体,故D符合题意;
综上所述,答案为D。
②SO2与碘化钾溶液不反应,因此SO2通入淀粉碘化钾溶液,现象为无明显现象,说明SO2与碘化钾溶液不能生成I2,表明 SO2 的氧化性比 I2弱;故答案为:无明显现象或溶液不变蓝;弱。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3 molL1的 NaOH溶液物质的量为0.3 molL1×0.1L =0.03mol,通入标准状况下0.448LSO2 气体即物质的量为![]() ,根据SO2+2NaOH=Na2SO3+H2O,SO2+NaOH = NaHSO3分析,由于
,根据SO2+2NaOH=Na2SO3+H2O,SO2+NaOH = NaHSO3分析,由于![]() ,说明所得溶液中的溶质两者都有,即化学式为Na2SO3和NaHSO3;故答案为:Na2SO3和NaHSO3。
,说明所得溶液中的溶质两者都有,即化学式为Na2SO3和NaHSO3;故答案为:Na2SO3和NaHSO3。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案