题目内容
【题目】以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
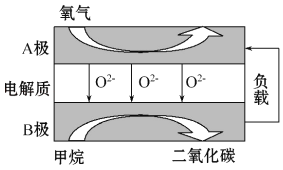
(1)B极电极反应式为______________________。
(2)若用该燃料电池作电源,用石墨作电极电解硫酸铜溶液,写出阳极的电极反应式________;当阳极收集到11.2L(标准状况)气体时,消耗甲烷的质量为__________g;电解硫酸铜溶液一段时间后,阴极无气体产生,要使原溶液复原,可向电解后的溶液中加入___________________。
(3)目前已开发出用电解法制取ClO2的新工艺,简易装置如图所示:
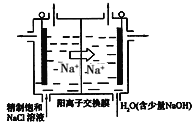
①若用上述甲烷燃料电池进行电解,则甲烷燃料电池的负极应该接该装置的_____(填“左”或“右”)边电极;写出阳极产生ClO2的电极反应式___________。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况下)时,停止电解。通过阳离子交换膜的阳离子的数目为__________。
【答案】CH4-8e-+4O2-=CO2+2H2O 2H2O-4e-=O2↑+4H+ 4 CuO 右 Cl--5e-+2H2O=ClO2+4H+ 0.01NA
【解析】
(1)B电极CH4变为CO2,根据阴离子移动方向,结合原电池反应原理,判断电极的正负,并写出电极反应式;
(2)用惰性电极电解硫酸铜溶液,阳极上溶液中OH-放电;阴极上溶液中的Cu2+放电;若阴极无气体放出,说明阴极只发生了反应:Cu2++2e-=Cu;两个电极析出的物质反应后得到的物质就是使溶液复原需加入的物质;
(3)①根据离子移动方向确定电解池的阳极、阴极,电解池的阴极接电源的负极;阳极上Cl-失去电子变为ClO2;
②阴极上溶液中的H+获得电子变为氢气,根据电子转移守恒,计算通过阳离子交换膜的阳离子的数目。
(1)由阴离子移动方向可知B电极为负极,在负极上甲烷失电子发生氧化反应,电极反应式为:CH4-8e-+4O2-=CO2+2H2O;
(2)用石墨电极电解硫酸铜溶液,石墨电极为惰性电极,电解硫酸铜溶液,实质上是溶液中的离子放电。在阳极上溶液中OH-放电,所以阳极的电极反应式为:2H2O-4e-=O2↑+4H+;阴极上溶液中的Cu2+放电,电极反应式为Cu2++2e-=Cu;阳极产生的是O2,每产生1molO2,转移4mol电子,n(O2)=11.2L÷22.4L/mol=0.5mol,则n(e-)=0.5×4=2mol,由于同一闭合回路中电子转移数目相等,所以根据CH4-8e-+4O2-=CO2+2H2O可知消耗1mol甲烷,转移8mol电子,则转移2mol电子,会消耗CH4的物质的量为n(CH4)=2mol÷8=0.25mol,则消耗甲烷的质量为m(CH4)=0.25mol×16g/mol=4g;
电解硫酸铜溶液一段时间后,若阴极无气体产生,则电解反应方程式为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,要使原溶液复原,可向电解后的溶液中加入的物质是Cu与O2反应产生的CuO;
2Cu+O2↑+2H2SO4,要使原溶液复原,可向电解后的溶液中加入的物质是Cu与O2反应产生的CuO;
(3)①Na+向阴极移动,阴极连接原电池的负极,接燃料电池中通入甲烷的电极;所以甲烷燃料电池的负极应该接该装置的右边的电极;在阳极上,溶液中的Cl-失去电子,变为ClO2,电极反应式为:Cl--5e-+2H2O=ClO2+4H+;
②阴极电极反应为2H2O+2e-=H2↑+2OH-,氢气的物质的量为n(H2)=0.112L÷22.4L/mol=0.005mol,阴极区产生0.01molOH-,通过阳离子交换膜的是+1价阳离子,故通过阳离子交换膜的阳离子的物质的量为0.01mol,通过的阳离子的数目为0.01NA。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】下列实验操作、现象、结论均完全正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 在常温下测定Na2CO3和NaHCO3溶液的pH | Na2CO3溶液pH较大 | 水解能力:Na2CO3大于NaHCO3 |
B | 先向盛有1mL 0.1mol/L的AgNO3溶液的试管中滴加两滴0.1mol/L的NaCl溶液,再向其中滴加0.1mol/L的NaI溶液。 | 滴加NaCl溶液有白色沉淀生成,滴加NaI溶液后有黄色沉淀生成 | AgCl沉淀可转化成AgI沉淀 |
C | 电解饱和CuCl2溶液实验中,用润湿的淀粉—碘化钾试纸靠近阳极 | 润湿的淀粉—碘化钾试纸变蓝 | 阳极产生Cl2 |
D | 饱和FeCl3溶液中加入少量NaCl固体 | 溶液颜色变浅 | 加入NaCl固体后,FeCl3的水解平衡逆向移动 |
A. AB. BC. CD. D