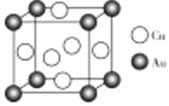
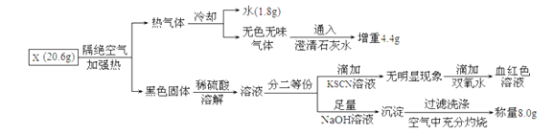
题目内容
【题目】取某固体样品,进行如下实验:
①取a g样品,加足量水充分溶解,得澄清透明溶液,未产生浑浊;
②取20mL溶液,加入足量氯水,无气体产生,再加入CCl4后分层,下层为橙红色;
③将②中溶液分液后,在上层溶液加入足量![]() 和盐酸,产生白色沉淀4.66g;
和盐酸,产生白色沉淀4.66g;
④另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体;
该固体样品可能是( )
A. NH4Cl NaBr (NH4)2SO4
B. CuBr2 NaCl (NH4)2SO3
C. NaBr Na2CO3 (NH4)2SO4
D. NaCl NaBr (NH4)2SO3
【答案】D
【解析】
根据每一个实验步骤得出相应的结论进行排除,考虑定性的同时注意定量的关系。
实验步骤①:取ag样品,加足量水充分溶解,得澄清透明溶液,未产生浑浊,说明各物质间不能发生反应生成沉淀,所给的选项B中各物质间会反应生成沉淀,B项排除;
实验步骤②:取20mL溶液,加入足量氯水,无气体产生,据此排除C项,C项会产生CO2气体;再加入CCl4后液体分层,下层为橙红色,说明原溶液中含有溴离子,A项和D项均符合;
实验步骤③:将步骤②中溶液分液后,在上层溶液加入足量BaCl2和盐酸,产生白色沉淀4.66g,这显然是0.02mol的BaSO4沉淀,A项有SO42-,D项有SO32-可被氯水氧化为SO42-,所以A项和D项均符合;
实验步骤④:另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体,该气体为0.02mol的氨气,说明原溶液中含有NH4+,则20mL原溶液中含有的NH4+应为0.04mol,即从量上来看,N和S原子的物质的量之比应是2:1,A项中N和S的物质的量之比明显大于2:1,不符合,而D项中N和S的物质的量之比恰好为2:1,所以答案选择D项。

【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
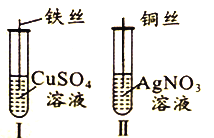
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。