题目内容
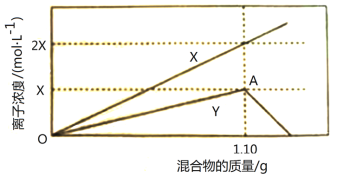
【题目】现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图,请计算出FeCl3、AlCl3的物质的量浓度各为_____ ______

【答案】FeCl3:4mol/L AlCl3:6mol/L
【解析】
根据Al(OH)3+OH-═AlO2-+2H2O、Al3+ + 3OH- ═ Al(OH)3↓、Fe3+ + 3OH-═Fe(OH)3↓反应关系,结合c=![]() 进行计算。
进行计算。
设n(Al3+)=n(Al(OH)3)=x,则由
Al(OH)3+OH-═AlO2-+2H2O
1 1
x (3.6-3)mol
x=(3.6-3)mol=0.6mol,
设n(Fe3+)=y,则
Al3+ + 3OH- ═ Al(OH)3↓
0.6mol 1.8mol 0.6mol
Fe3+ + 3OH-═Fe(OH)3↓
1 3
y (3-1.8)mol
![]() =
=![]()
解得y=0.4mol,
c(FeCl3)=![]() =4mol/L;c(AlCl3)=
=4mol/L;c(AlCl3)=![]() =6mol/L;
=6mol/L;
答:FeCl3、AlCl3的物质的量浓度分别为4mol/L、6mol/L
【点晴】
本题考查金属及化合物的性质,明确发生的化学反应与图象的对应关系是解答本题的关键,然后利用消耗的NaOH的物质的量代入离子反应方程式计算即可解答,重点是要抓住发生的反应有Fe3++3OH-═Fe(OH)3↓、Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,然后结合图中消耗的NaOH的物质的量来计算。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目