题目内容
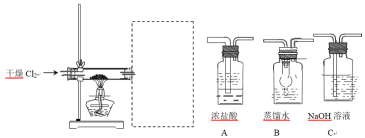
【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
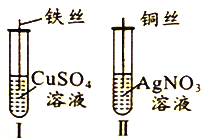
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。
【答案】AgNO3=Ag++NO3- 铁丝上有红色固体析出 氧化性Ag+>Cu2+ Cu+2Ag+=Cu2++2Ag 2 CuSO4、AgNO3在水溶液中电离出自由离子
【解析】
(1)AgNO3是强电解质,在水溶液中完全电离。
(2)①实验Ⅰ,Fe与CuSO4发生置换反应,在铁表面生成紫红色的铜。
②实验Ⅱ,Cu与AgNO3发生置换反应,氧化剂的氧化性大于氧化产物的氧化性。
③实验Ⅱ中,Cu与Ag+发生置换反应。
(3)金属单质属于纯净物,CuSO4溶液、AgNO3溶液中含有自由离子,所以能导电。
(1)AgNO3是强电解质,电离方程式为AgNO3=Ag++NO3-。答案为:AgNO3=Ag++NO3-;
(2)①实验Ⅰ,Fe与CuSO4发生置换反应,在铁表面生成紫红色的铜。答案为:铁丝上有红色固体析出;
②实验Ⅱ,Cu与AgNO3发生置换反应,结论是:氧化性Ag+>Cu2+。答案为:氧化性Ag+>Cu2+;
③实验Ⅱ中,Cu与Ag+发生置换反应,离子方程式为Cu+2Ag+=Cu2++2Ag。答案为:Cu+2Ag+=Cu2++2Ag;
(3)金属单质属于纯净物,其中属于纯净物有Cu、Fe共2种,CuSO4溶液、AgNO3溶液中含有自由离子,所以能导电。答案为:2;CuSO4、AgNO3在水溶液中电离出自由离子。

 阅读快车系列答案
阅读快车系列答案