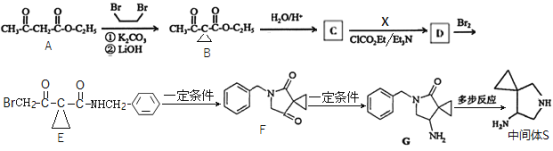
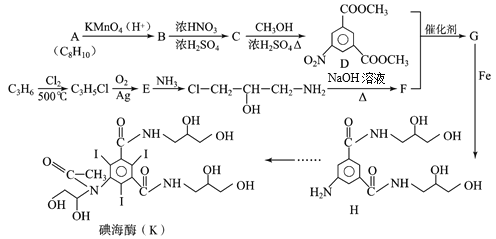
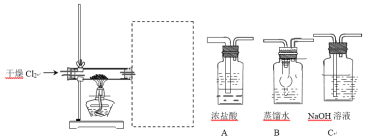
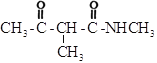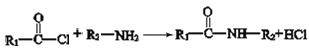题目内容
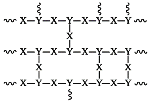
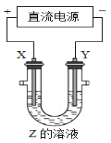
【题目】有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如图实验:
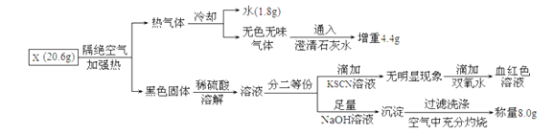
请回答:
(1)X的化学式____。
(2)X隔绝空气加热的化学反应方程式为:___。
(3)用化学方程式表示在空气中变黄的原因____。
(4)写出检验溶液A中存在的金属阳离子的实验方法:____。
【答案】![]()
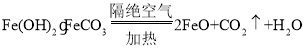
![]() 取少量溶液A于试管中,加入少量
取少量溶液A于试管中,加入少量![]() 溶液,无明显现象,再加入少量双氧水溶液,呈现血红色,证明溶液中含
溶液,无明显现象,再加入少量双氧水溶液,呈现血红色,证明溶液中含![]()
【解析】
矿物X挖出后在空气中容易发黄,推测该矿物中含有Fe2+。无色无味能与石灰水反应的气体,排除了二氧化硫的可能性,该气体为二氧化碳气体。分解产物中还有水,所以矿物X的4种组成元素为Fe、C、H、O。20.6g X隔绝空气加强热得到热气体和黑色固体,热气体冷却后得到水1.8g,其物质的量为0.1mol,无色无味气体应为二氧化碳,通入澄清石灰水生成碳酸钙沉淀,溶液增重4.4g即为二氧化碳的质量,其物质的量为0.1mol。因隔绝空气加强热,所以黑色固体中应为氧化亚铁。经硫酸溶解后,加足量的NaOH溶液生成沉淀,在空气中充分灼烧后得到氧化铁,其质量为16.0g,其物质的量为0.1mol。所以物X中n(Fe):n(H):n(C)=0.2:0.2:0.1=2:2:1,据化合价代数和为0来配上氧原子数。矿物X的化学式为Fe(OH)2·FeCO3或Fe2(OH)2CO3。
(1)据以上分析,矿物X的化学式为Fe(OH)2·FeCO3或Fe2(OH)2CO3,表达出原子个数比即可。
(2)X隔绝空气加热的化学反应方程式为:![]() ;
;
(3)在空气中变黄,是+2价铁被氧化成+3价铁:2Fe(OH)2·FeCO3+O2=2Fe2O3+2CO2↑+2H2O;
(4)溶液A的阳离子是Fe2+,检验的方案是:取少量溶液A于试管中,加入少量KSCN溶液,无明显现象,再加入少量双氧水(或氯水),溶液变为血红色,说明原溶液中含有Fe2+。

 53随堂测系列答案
53随堂测系列答案