题目内容
【题目】在标准状况下,在三个干燥的烧瓶内分别装有:①干燥且纯净的NH3;②含一半空气的氯化氢气体;③NO2和O2体积比为4:1的混合气体。然后分别做喷泉实验,实验结束后假设三个烧瓶中所得溶液不扩散,则三个烧瓶中所得溶液的物质的量浓度之比为
A.5:5:4B.2:1:2C.1:1:1D.无法确定
【答案】A
【解析】
假设烧瓶体积为5V L,则干燥纯净的氨气体积为5V L,完全溶于水后烧瓶充满溶液溶液体积也是5V L,溶质物质的量浓度为c(NH3)= =
=![]() mol/L;
mol/L;
含一半空气的氯化氢烧瓶中氯化氢体积为2.5VL完全溶解后烧瓶进水![]() ,也就是溶液体积为2.5V L,所以溶质物质的量浓度为c(HCl)=
,也就是溶液体积为2.5V L,所以溶质物质的量浓度为c(HCl)= =
=![]() mol/L;
mol/L;
二氧化氮与氧气体积比为4:1的混合气中NO2体积为4V L,根据方程式:4NO2+O2+2H2O=4HNO3,可知生成硝酸物质的量n(HNO3)=![]() mol,由于完全反应所以烧瓶充满溶液其体积为5V L,所以溶质的物质的量浓度为c(HNO3)=
mol,由于完全反应所以烧瓶充满溶液其体积为5V L,所以溶质的物质的量浓度为c(HNO3)=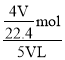 =
=![]() mol/L,故三个烧瓶中所得溶液的溶质的物质的量浓度之比为:
mol/L,故三个烧瓶中所得溶液的溶质的物质的量浓度之比为:![]() :
:![]() :
:![]() =5:5:4。
=5:5:4。
答案选A。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目