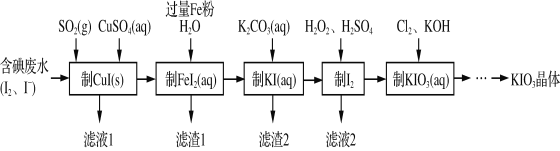
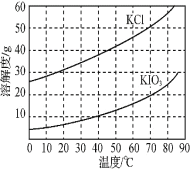
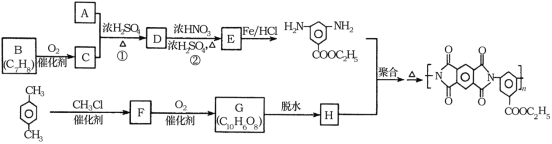
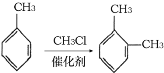
题目内容
【题目】I.有下列物质:①钠 ②金刚石 ③冰 ④Na2O2 ⑤MgCl2 ⑥氯化铵 ⑦水晶 ⑧Cl2
(1)属于原子晶体的是_________,属于金属晶体的是_________。
(2)既含有离子键又含有共价键的是_________。
(3)③熔化时克服作用力的有_________。
(4)Na2O2的电子式 ________________。
(5)②、③、⑤、⑦、⑧熔点由低到高的顺序为________________。
II.在生产生活以及化学科学研究中,水都有重要的作用。
(1)与H2O分子是等电子体的微粒_________(阴离子及分子各写一个)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是__________。
A.微粒的形状发生了改变
B.氧原子的杂化类型发生了改变
C.微粒中的键角发生了改变
D.微粒的化学性质发生了改变
(3)向CuSO4溶液中加入氨水,溶液变成深蓝色,请写出发生此变化的离子方程式______________。
【答案】②⑦ ① ④⑥ 范德华力、氢键 ![]() ⑧、③、⑤、⑦、② NH2-、H2S B Cu2++4NH3=[Cu(NH3)4]2+
⑧、③、⑤、⑦、② NH2-、H2S B Cu2++4NH3=[Cu(NH3)4]2+
【解析】
Ⅰ.(1)根据构成晶体的微粒判断;
(2)依据化学键的类型判断;
(3)依据冰晶体中存在的作用力作答;
(4)Na2O2由钠离子与过氧根离子构成;
(5)依据晶体的类型及熔沸点判断的依据作答。
Ⅱ.(1)等电子体是指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团;
(2)依据价层电子对互斥理论和杂化轨道类型作答;
(3)硫酸铜先和氨水反应生成氢氧化铜沉淀,氢氧化铜和氨水反应生成络合物。
Ⅰ.(1)④Na2O2 ⑤MgCl2 ⑥氯化铵这三种物质是由阴阳离子构成的,属离子晶体;③冰⑧Cl2这两种物质是由分子构成的,属分子晶体;②金刚石⑦水晶这两种物质是由原子构成的,属原子晶体;①钠属于金属晶体,
综上所述,(1)属于原子晶体的是②⑦,属于金属晶体的是①;
(2)④Na2O2是由钠离子与过氧根离子构成,过氧根离子中含非极性共价键;⑥氯化铵是由铵根离子与氯离子构成,铵根离子中N与H以极性共价键和配位键结合,配位键属于特殊的共价键,则既含有离子键又含有共价键的是④⑥;
(3)③冰分子间存在范德华力和氢键,熔化时克服作用力的有范德华力和氢键;
(4)Na2O2分子内离子键和共价键,其电子式为:![]() ;
;
(5)②金刚石和⑦水晶为原子晶体,C-C键的键能大于Si-O键的键能,则②金刚石的熔点大于⑦水晶的熔点;③冰和⑧Cl2为分子晶体,冰常温下为固体,Cl2常温下是气体,则③冰的熔点大于⑧Cl2的熔点;⑤MgCl2为离子晶体,一般地熔点比较:分子晶体<离子晶体<原子晶体,因此②、③、⑤、⑦、⑧熔点由低到高的顺序为⑧、③、⑤、⑦、②;
II. (1)H2O分子中的原子数为3,价电子数为10,H2S、NH2-的原子数目均为3,价电子数目均为10,则与水互为等电子体,故答案为:H2S、NH2-;
(2)A. 水分子为V型,H3O+为三角锥型,则微粒的形状发生了改变,A项正确;
B. 水中氧的杂化为sp3,H3O+中氧的杂化为sp3,则氧原子的杂化类型没有改变,B项错误;
C. 水分子为V型,H3O+为三角锥型,微粒中的键角发生了改变,C项正确;
D. 因结构不同,则性质不同,微粒的化学性质发生了改变,D项正确;
故答案为:B;
(3)氨水和铜离子反应生成可溶性的铜氨络合物,得到深蓝色的透明溶液,反应的离子方程式为:Cu2++4NH3=[Cu(NH3)4]2+。

 阅读快车系列答案
阅读快车系列答案【题目】FeCl3是重要的化工原料,无水氯化铁在300℃时升华,极易潮解。
I.制备无水氯化铁。
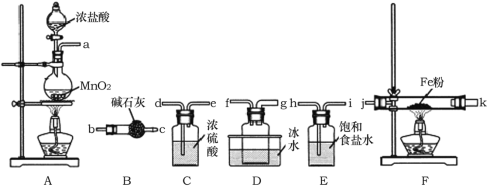
(1)A装置中发生反应的离子方程式为______________。
(2)装置的连接顺序为a→______________→j,k→______________(按气流方向,用小写字母表示)。
(3)实验结束后,取少量F装置玻璃管中的固体加水溶解,经检测,发现溶液中含有Fe2+,可能原因为______________。
II.探究FeCl3与SO2的反应。
(4)已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)63+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为______________。
(5)实验步骤如下,并补充完整。
步骤 | 现象 | 结论 |
①取5mL1mol·L-1FeCl3溶液于试管中,通入SO2至饱和。 | 溶液很快由黄色变为红棕色 | |
②用激光笔照射步骤①中的红棕色液体。 | _______________ | 红棕色液体不是Fe(OH)3胶体 |
③将步骤①中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色 | |
④向步骤③中溶液加入2滴___________ 溶液(填化学式)。 | _______________ | 溶液中含有Fe2+ |
(6)从上述实验可知,反应(i)、(ii)的活化能大小关系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。