ЬтФПФкШн
ЁОЬтФПЁПA+ЁЂB2-ЁЂC-ЁЂDЁЂEЁЂF3+ЗжБ№БэЪОКЌ10ИіЕчзгЕФСљжжСЃзг(РызгЛђЗжзг)ЁЃЦфжаЃК
aЃЎA+ЁЂB2-ЁЂF3+КЫЭтЕчзгВуНсЙЙЯрЭЌ
bЃЎC-ЪЧгЩСНжждЊЫизщГЩЕФ
cЃЎDЪЧСНжждЊЫизщГЩЕФЫФдзгЗжзг
dЃЎEдкГЃЮТЯТЪЧЮоЩЋвКЬх
eЃЎЭљКЌF3+ЕФШмвКжаЕЮМгКЌC-ЕФШмвКжСЙ§СПЃЌЯШгаАзЩЋГСЕэЩњГЩЃЌКѓАзЩЋГСЕэЯћЪЇ
(1)C-ЕФЕчзгЪН___ЁЃ
(2)A+ЁЂB2-ЁЂF3+РызгАыОЖгЩДѓЕНаЁЕФЫГађЮЊ___(гУРызгЗћКХБэЪО)ЁЃ
(3)КЌF3+ЕФШмвКжаЭЈШыЙ§СПDЃЌЗДгІЕФРызгЗНГЬЪНЪЧ___ЁЃ
(4)AЕЅжЪгыEЗДгІЕФРызгЗНГЬЪНЮЊ___ЃЌЩњГЩЕФЛЏКЯЮяжаЛЏбЇМќЕФРраЭЪЧ___ЁЃ
ЁОД№АИЁП![]() O2-ЃОNa+ЃОAl3+ Al3++3NH3H2O=Al(OH)3Ё§+3NH
O2-ЃОNa+ЃОAl3+ Al3++3NH3H2O=Al(OH)3Ё§+3NH![]() 2Na+2H2O=2Na++2OH-+H2Ёќ РызгМќКЭМЋадМќ
2Na+2H2O=2Na++2OH-+H2Ёќ РызгМќКЭМЋадМќ
ЁОНтЮіЁП
A+ЁЂB2-ЁЂC-ЁЂDЁЂEЁЂF3+ЗжБ№БэЪОКЌ10ИіЕчзгЕФСљжжСЃзг(РызгЛђЗжзг)ЃЌЦфжаaЃЎA+ЁЂB2-ЁЂF3+КЫЭтЕчзгВуНсЙЙЯрЭЌЃЌПЩжЊAЮЊNaЁЂBЮЊOЁЂFЮЊAlЃЛbЃЎC-ЪЧгЩСНжждЊЫизщГЩЕФЃЌC-ЮЊOH-ЃЛcЃЎDЪЧСНжждЊЫизщГЩЕФЫФдзгЗжзгЃЌDЮЊNH3ЃЛdЃЎEдкГЃЮТЯТЪЧЮоЩЋвКЬхЃЌEЮЊH2OЃЛЭљКЌF3+ЕФШмвКжаЕЮМгКЌC-ЕФШмвКжСЙ§СПЃЌЯШгаАзЩЋГСЕэЩњГЩЃЌКѓАзЩЋГСЕэЯћЪЇЃЌАзЩЋГСЕэЮЊЧтбѕЛЏТСЃЌзлКЯЗжЮіПЩжЊЃКAЮЊNaЁЂBЮЊOЁЂC-ЮЊOH-ЁЂDЮЊNH3ЁЂEЮЊH2O ЁЂFЮЊAlЃЌОнДЫЗжЮіЁЃ
(1)C-ЪЧЧтбѕИљРызгЃЌбѕдзгзюЭтВуТњзу8ЕчзгНсЙЙЃЌЫќЕФЕчзгЪНЮЊ![]() ЃЛ
ЃЛ
(2)A+ЁЂB2-ЁЂF3+ЗжБ№ЮЊNa+ЁЂO2-ЁЂAl3+ЃЌКЫЭтЕчзгХХВМЯрЭЌЕФРызгЃЌКЫЕчКЩЪ§дНДѓЃЌдзгКЫЖдКЫЭтЕчзгЕФЮќв§ФмСІдНЧПЃЌАыОЖдНаЁЃЌАыОЖгЩДѓЕНаЁЕФЫГађЮЊO2-ЃОNa+ЃОAl3+ЃЛ
(3)КЌF3+ЕФШмвКжаЭЈШыЙ§СПDЃЌЗЂЩњЕФЗДгІЪЧТСРызгКЭАБЫЎЕФЗДгІЃЌЗДгІЕФРызгЗНГЬЪНЪЧAl3++3NH3H2O=Al(OH)3Ё§+3NH![]() ЃЛ
ЃЛ
(4)ФЦЕЅжЪгыЫЎЗДгІЩњГЩЧтбѕЛЏФЦКЭЧтЦјЃЌРызгЗНГЬЪНЮЊ2Na+2H2O=2Na++2OH-+H2ЁќЃЌЩњГЩЕФЛЏКЯЮяЪЧЧтбѕЛЏФЦЃЌЛЏбЇМќЕФРраЭЪЧРызгМќКЭЙВМлМќЁЃ

ЁОЬтФПЁПдк2LУмБеШнЦїФкЃЌ800ЁцЪБЗДгІЃК2NO(g)+O2(g)![]() 2NO2(g)ЬхЯЕжаЃЌn(NO)ЫцЪБМфЕФБфЛЏШчБэЃК
2NO2(g)ЬхЯЕжаЃЌn(NO)ЫцЪБМфЕФБфЛЏШчБэЃК
ЪБМф(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
ЃЈ1ЃЉЭМжаБэЪОNO2ЕФБфЛЏЕФЧњЯпЪЧ___(ЬюзжФИ)ЃЛ
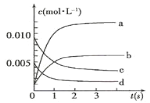
ЃЈ2ЃЉ800ЁцЃЌЗДгІДяЕНЦНКтЪБЃЌNOЕФзЊЛЏТЪЪЧ___ЁЁЃЛ
ЃЈ3ЃЉгУO2БэЪОДг0~2sФкИУЗДгІЕФЦНОљЫйТЪv=___ЁЃ
ЁОЬтФПЁПдк2LУмБеШнЦїФкЃЌtЁцЪБЗЂЩњЗДгІЃКN2(g)+3H2(g)2NH3(g)ЃЌдкЬхЯЕжаЃЌn(N2)ЫцЪБМфЕФБфЛЏШчЯТБэЃК
ЪБМф(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2ЕФЮяжЪЕФСП(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)ЩЯЪіЗДгІдкЕк4minЪБЃЌN2ЕФзЊЛЏТЪЮЊ___ЃЛ
(2)гУH2БэЪОДг0ЁЋ2minФкИУЗДгІЕФЦНОљЫйТЪv(H2)=___ЃЛ
(3)tЁцЪБЃЌдк4ИіОљЮЊ2LУмБеШнЦїжаВЛЭЌЭЖСЯЯТНјааКЯГЩАБЗДгІЁЃИљОндкЯрЭЌЪБМфФкВтЖЈЕФНсЙћЃЌХаЖЯИУЗДгІНјааПьТ§ЕФЫГађЮЊ__ЁЃ(гУзжФИЬюПеЃЌЯТЭЌ)ЃЛ
aЃЎv(NH3)=0.04molЁЄL-1ЁЄmin-1 bЃЎv(H2)=0.03molЁЄL-1ЁЄmin-1
cЃЎv(N2)=0.03molЁЄL-1ЁЄmin-1 dЃЎv(H2)=0.00lmolЁЄL-1ЁЄs-1
(4)ЦНКтЪБШнЦїФкЦјЬхЕФбЙЧПгыЦ№ЪМЪББШ__(ЬюЁАБфДѓЁБЃЌЁАБфаЁЁБЛђЁАЯрЕШЁБЯТЭЌ)ЃЌЛьКЯЦјЬхЕФУмЖШгыЦ№ЪМЪББШ___ЁЃ
(5)НЋamolN2гыbmolH2ЕФЛьКЯЦјЬхЗЂЩњЩЯЪіЗДгІЃЌЗДгІЕНФГЪБПЬИїЮяжЪЕФСПЧЁКУТњзуЃКn(N2)=n(H2)=2n(NH3)ЃЌдђдЛьКЯЦјЬхжаaЃКb=___ЁЃ
(6)ЯТСаБэЪіФмзїЮЊЗДгІДяЕНЛЏбЇЦНКтзДЬЌЕФБъжОЪЧ__ЁЃ
aЃЎЗДгІЫйТЪv(N2)ЃКv(H2)ЃКv(NH3)=1ЃК3ЃК2
bЃЎИїзщЗжЕФЮяжЪЕФСПХЈЖШВЛдйИФБф
cЃЎЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПВЛдйИФБф
dЃЎЛьКЯЦјЬхЕФУмЖШВЛБф
eЃЎЕЅЮЛЪБМфФкЩњГЩnmolN2ЕФЭЌЪБЃЌЩњГЩ3nmolH2
fЃЎv(N2)ЯћКФ=2v(NH3)ЯћКФ
gЃЎЕЅЮЛЪБМфФк3molHЁЊHМќЖЯСбЕФЭЌЪБ2molNЁЊHМќвВЖЯСб