题目内容
【题目】实验室用氨气还原氧化铜的方法测定铜的近似相对原子质量,反应的化学方程式为:2NH3+3CuO![]() N2+3Cu+3H2O,试回答:
N2+3Cu+3H2O,试回答:
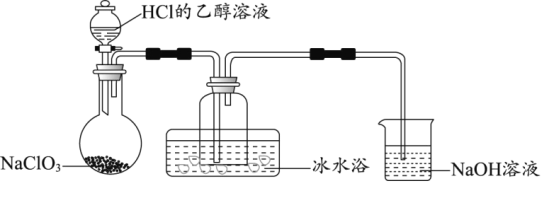
(1)如果选用测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)] 时,请用下图所列仪器设计一个简单的实验方案。
(2)①请写出用下图装置制备氨气的化学反应方程式___________________。

②仪器连接的顺序为(用字母编号表示,仪器可重复使用) ______________________,(d)中浓硫酸的作用是___________,实验完毕时观察到(a)中的现象是______________________。
③列出计算Cu的相对原子质量的表达式:______________________。
(2)有同学认为NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。
①若CuO未完全分解,则所测定的Cu的相对原子质量会______________(偏大或偏小)。
②请设计一个简单的实验检验该红色物质中是否含有Cu2O________________。
(3)在解决了问题(2)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取0.98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末B。如下图所示:
据此可推得A为__________,且AB段发生的反应为_________________,
由此得到的热稳定性的结论是____________________。

【答案】2NH4Cl+Ca(OH)2 ![]() CaCl2 +2NH3
CaCl2 +2NH3![]() + 2H2O bcacd 吸收未反应的氨气;防止空气中水分进入 固体由黑色转变为红色
+ 2H2O bcacd 吸收未反应的氨气;防止空气中水分进入 固体由黑色转变为红色 ![]() -16 偏大 取少量样品于试管中,加入稀H2SO4,充分振荡,若溶液变成蓝色,说明红色物质中含有Cu2O,反之,则没有Cu2O CuO 4CuO
-16 偏大 取少量样品于试管中,加入稀H2SO4,充分振荡,若溶液变成蓝色,说明红色物质中含有Cu2O,反之,则没有Cu2O CuO 4CuO![]() 2Cu2O+O2
2Cu2O+O2![]() CuO热稳定性不如Cu2O
CuO热稳定性不如Cu2O
【解析】
(1)①NH4Cl与Ca(OH)2混合加热,发生复分解反应产生NH3,据此书写方程式;
②根据题给要求要测量氧化铜和水的质量,考虑到氨气可以和浓硫酸反应,但是不和碱石灰反应,所以应该用碱石灰来吸收NH3中的水蒸气,而用浓硫酸来吸收氨气,同时要注意防止空气中的水对实验的干扰,根据CuO及反应产生的Cu的颜色变化分析实验现象;
③根据水和氧化铜的质量结合化学方程式2NH3+3CuO![]() N2+3Cu+3H2O进行计算,即可求出铜的相对原子质量;
N2+3Cu+3H2O进行计算,即可求出铜的相对原子质量;
(2)①根据(1)中③计算的结果,分析实验误差;
②根据Cu2O与酸混合发生歧化反应分析判断;
(3)先计算0.98 g Cu(OH)2固体的物质的量,利用Cu元素守恒,结合80℃~100℃时,得到黑色固体粉末的质量确定物质成分,再根据B的质量,利用元素守恒确定其成分,从而可判断比较物质稳定性的强弱。
(1)①在实验室中用NH4Cl与Ca(OH)2混合加热制取氨气,反应方程式为:2NH4Cl+Ca(OH)2 ![]() CaCl2 +2NH3
CaCl2 +2NH3![]() + 2H2O;
+ 2H2O;
②根据题给要求来测量氧化铜和水的质量,考虑到氨气可以和浓硫酸反应,但不和碱石灰反应,所以应该用碱石灰来吸收水,用浓硫酸来吸收氨气,由于在制取氨气的过程中会产生水,所以应该先对b装置反应产生的氨气进行干燥,即选择c装置,然后进行实验,最后为了防止氨气污染空气,所以要用浓硫酸来处理尾气,即正确的操作顺序为:b→c→a→c→d;d中浓硫酸的作用是吸收产生的多余NH3,同时防止空气中H2O进入(c)中影响结果;实验完毕时观察到(a)中的现象是固体粉末由黑色变为红色;
③设铜的相对原子质量为x,2NH3+3CuO![]() N2+3Cu+3H2O,根据方程式中物质转化关系可知:CuO与H2O的质量比为[3×(x+16)]:54,则m(CuO)产生H2O质量为m(H2O),可得比例式:
N2+3Cu+3H2O,根据方程式中物质转化关系可知:CuO与H2O的质量比为[3×(x+16)]:54,则m(CuO)产生H2O质量为m(H2O),可得比例式:![]() ,解得x=
,解得x=![]() -16;
-16;
(2)①如果氧化铜没有完全被还原为Cu单质,则会m(H2O)偏小,最终导致结算结果偏大;
②Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu,所以检验该红色物质中是否含有Cu2O,方法是:取少量样品于试管中,加入稀H2SO4,充分振荡,若溶液变成蓝色,说明红色物质中含有Cu2O,反之,则没有Cu2O;
(3)0.98 g Cu(OH)2固体的物质的量n[Cu(OH)2]=![]() =0.01 mol,根据Cu元素守恒,可知其中0.01 mol Cu(OH)2固体中含有Cu物质的量是0.01 mol,Cu的质量为m(Cu)=0.01 mol×64 g/mol=0.64 g,则固体A中含有O的质量为m(O)=0.80 g-0.64 g=0.16 g,n(O)
=0.01 mol,根据Cu元素守恒,可知其中0.01 mol Cu(OH)2固体中含有Cu物质的量是0.01 mol,Cu的质量为m(Cu)=0.01 mol×64 g/mol=0.64 g,则固体A中含有O的质量为m(O)=0.80 g-0.64 g=0.16 g,n(O)![]() =0.01 mol,n(Cu):n(O)=1:1,所以A化学式为CuO;继续加热到1000℃以上,黑色粉末全部变成红色粉末B,固体质量变为0.72 g,其中O原子的质量m(O)=0.72 g-0.64 g=0.08 g,n(O)
=0.01 mol,n(Cu):n(O)=1:1,所以A化学式为CuO;继续加热到1000℃以上,黑色粉末全部变成红色粉末B,固体质量变为0.72 g,其中O原子的质量m(O)=0.72 g-0.64 g=0.08 g,n(O)![]() =0.005 mol,n(Cu):n(O)=0.01 mol:0.005 mol=2:1,则B化学式为Cu2O,因此AB段发生的反应为:4CuO
=0.005 mol,n(Cu):n(O)=0.01 mol:0.005 mol=2:1,则B化学式为Cu2O,因此AB段发生的反应为:4CuO![]() 2Cu2O+O2
2Cu2O+O2![]() ,CuO加热至1000℃以上分解变为Cu2O,说明物质的稳定性:CuO<Cu2O。
,CuO加热至1000℃以上分解变为Cu2O,说明物质的稳定性:CuO<Cu2O。

【题目】FeCl3是重要的化工原料,无水氯化铁在300℃时升华,极易潮解。
I.制备无水氯化铁。
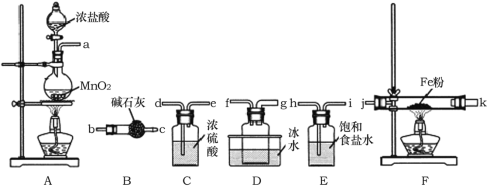
(1)A装置中发生反应的离子方程式为______________。
(2)装置的连接顺序为a→______________→j,k→______________(按气流方向,用小写字母表示)。
(3)实验结束后,取少量F装置玻璃管中的固体加水溶解,经检测,发现溶液中含有Fe2+,可能原因为______________。
II.探究FeCl3与SO2的反应。
(4)已知反应体系中存在下列两种化学变化:
(i)Fe3+与SO2发生络合反应生成Fe(SO2)63+(红棕色);
(ii)Fe3+与SO2发生氧化还原反应,其离子方程式为______________。
(5)实验步骤如下,并补充完整。
步骤 | 现象 | 结论 |
①取5mL1mol·L-1FeCl3溶液于试管中,通入SO2至饱和。 | 溶液很快由黄色变为红棕色 | |
②用激光笔照射步骤①中的红棕色液体。 | _______________ | 红棕色液体不是Fe(OH)3胶体 |
③将步骤①中的溶液静置。 | 1小时后,溶液逐渐变为浅绿色 | |
④向步骤③中溶液加入2滴___________ 溶液(填化学式)。 | _______________ | 溶液中含有Fe2+ |
(6)从上述实验可知,反应(i)、(ii)的活化能大小关系是:E(i)________E(ii)(填“>”、“<”或“=”,下同),平衡常数大小关系是:K(i)__________K(ii)。