题目内容
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有强还原性。下列说法正确的是( )
A.NaH2PO2属于酸式盐,其水溶液呈碱性
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2 + 3OH- =![]() + 3H2O
+ 3H2O
C.向NaH2PO2溶液中滴加浓硝酸反应的离子方程式为:![]() + H+=H3PO2
+ H+=H3PO2
D.利用 (H3PO2)进行化学镀银反应中,1molH3PO2 最多还原 4 mol Ag+离子
【答案】D
【解析】
A. NaH2PO2是次磷酸的正盐,在水溶液中不能电离出氢离子,NaH2PO2属于强碱弱酸盐,水溶液中![]() 水解,其水溶液呈碱性,A错误;
水解,其水溶液呈碱性,A错误;
B. 一元弱酸与NaOH按照物质的量1:1反应,所以H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2 + OH- =![]() + H2O,B错误;
+ H2O,B错误;
C. H3PO2具有强还原性,易被浓硝酸氧化,向NaH2PO2溶液中滴加浓硝酸不能得到H3PO2,C错误;
D. H3PO2中O元素的化合价为-2价,H元素的化合价为+1价,则P元素的化合价为+1价,那么其氧化产物为H3PO4,磷酸中P元素的化合价为+5价,所以1molH3PO2最多还原 4mol Ag+离子,D正确;故答案为:D。

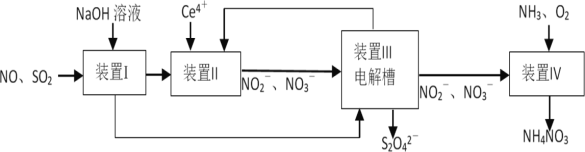
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子”,他们以教材中相关(科学探究)为基础,设计了如图实验装置并记录相关实验数据。
(实验装置)
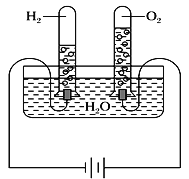
(部分实验数据)
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30 ℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30 ℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2的物质的量分别是________mol、________mol。
(2)该温度下,气体摩尔体积是__________。
(3)在该实验条件下,3 mol O2的气体的体积为____________L