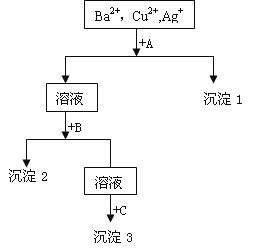
题目内容
【题目】已知X、Y、Z、W、M、N为短周期元素且原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在18电子的化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是___,Y2X6所含有的化学键类型是___。
(2)写出X2W2的电子式___;Z2X4结构式___。
(3)用电子式描述M2N化合物的形成程_____。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为____。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式____。
(6)熔融盐燃料电池具有高的发电效率,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,YW为负极燃气,空气和YW2的混合气体为正极助燃气,制得在650℃下工作的燃料电池。电池工作时的负极反应式为:____。
【答案】第二周期第ⅣA族 极性键和非极性键或共价键 ![]()
![]()
![]() H+ +HSO3-=SO2↑+H2O N2H4 +2H2O2=N2↑+4H2O CO+CO32--2e-=2CO2
H+ +HSO3-=SO2↑+H2O N2H4 +2H2O2=N2↑+4H2O CO+CO32--2e-=2CO2
【解析】
根据在18电子的化合物Y2X6、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,可知X为H;Y为C;Z为N;W为O;X与M、W与N分别同主族,X、Y、Z、W、M、N为短周期元素且原子序数依次增大,确定M为Na;N为S;总结X为H、Y为C、Z为N、W为O、M为Na、N为S,据此分析。
(1)Y元素为C,在周期表中的位置是第二周期第ⅣA主族,Y2X6(C2H6)的结构式为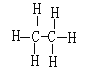 , 所含有的化学键类型是极性键和非极性键或共价键;
, 所含有的化学键类型是极性键和非极性键或共价键;
答案:第二周期第ⅣA族 极性键和非极性键或共价键;
(2)分子内各原子最外层电子都满足稳定结构,X2W2(H2O2)的电子式![]() ;Z2X4(N2H4)结构式
;Z2X4(N2H4)结构式![]() ;
;
答案:![]()
![]()
(3)Na2S为离子化合物,用电子式书写表示形成过程为![]() ;
;
答案:![]()
(4)均含X、W、M、N四种元素的两种化合物为NaHSO4和NaHSO3相互反应有SO2气体放出,反应的离子方程式为H+ +HSO3-=SO2↑+H2O;
答案:H+ +HSO3-=SO2↑+H2O;
(5)N2H4与H2O2反应生成氮气和水,二者反应的方程式为N2H4 +2H2O2=N2↑+4H2O;
答案:N2H4 +2H2O2=N2↑+4H2O;
(6)可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气和CO2的混合气体为正极助燃气,负极电极反应式为 CO+CO32--2e-=2CO2,正极电极反应式为2CO2+O2+4e-=2CO32-,总反应方程式为2CO+O2=2CO2;
答案:.CO+CO32--2e-=2CO2