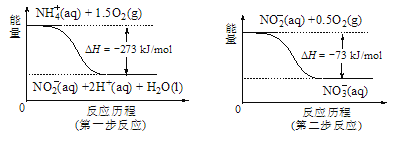
题目内容
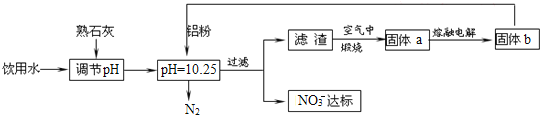
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。如图是在实验室中制备KMnO4晶体的流程:
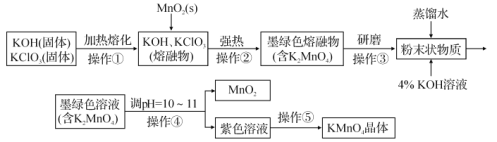
回答下列问题:
(1)在实验流程中,操作①和②均需在坩埚中进行,根据实验实际应选择___(填序号)。
a.铁坩埚 b.石英坩埚 c.瓷坩埚 d.氧化铝坩埚
(2)“熔融物”中KClO3应过量的原因除了提高MnO2利用率外,还有_______。
(3)操作④是使K2MnO4转化为KMnO4和MnO2,该转化过程中发生反应的离子方程式为___。若溶液碱性过强,则![]() 又会转化为
又会转化为![]() ,同时产生无色气体,该转化过程中发生反应的离子方程式为___。
,同时产生无色气体,该转化过程中发生反应的离子方程式为___。
(4)还可采用电解K2MnO4溶液(绿色)的方法制备KMnO4(装置如图所示)。
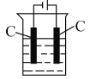
①电解过程中右侧石墨电极的电极反应式为________。
②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是________。
③为避免该现象,请提出改进装置的措施:________。
【答案】a KClO3会分解 3![]() +2H2O=2
+2H2O=2![]() +MnO2↓+4OH- 4
+MnO2↓+4OH- 4![]() +4OH-=4
+4OH-=4![]() +O2↑+2H2O
+O2↑+2H2O ![]() -e-=
-e-=![]() 电解较长时间后,阳极产生的
电解较长时间后,阳极产生的![]() 在阴极被还原,溶液颜色由紫色转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,
在阴极被还原,溶液颜色由紫色转变为绿色(或阴极上氢离子放电生成氢气,同时产生大量的氢氧根离子,溶液碱性增强,![]() 转化为
转化为![]() ,溶液颜色由紫色转变为绿色) 在两电极之间增加阳离子交换膜,阴极室用氢氧化钾溶液,阳极室用锰酸钾溶液
,溶液颜色由紫色转变为绿色) 在两电极之间增加阳离子交换膜,阴极室用氢氧化钾溶液,阳极室用锰酸钾溶液
【解析】
KOH与KClO3固体混合物在铁坩埚中加热至熔化,然后向其中加入MnO2,发生氧化还原反应产生K2MnO4、KCl,将所得固体冷却后研磨,得到固体粉末,然后加入蒸馏水,并加入4%KOH溶液,调整溶液pH至10~11,K2MnO4发生歧化反应产生MnO2、KMnO4,然后过滤除去MnO2固体,得到的溶液中含KMnO4,然后将溶液蒸发浓缩、冷却结晶得到KMnO4晶体。
(1)在实验流程中,操作①和②均需在坩埚中进行,由于物质中含有强碱KOH,KOH能够与石英坩埚、瓷坩埚中的SiO2反应,也能够与氧化铝坩埚中的Al2O3发生反应,因此应该选用铁坩埚,故合理选项是a;
(2)“熔融物”中KClO3应过量,原因除了可以提高MnO2利用率外,还有就是KClO3不稳定,受热分解产生KCl和O2;
(3)K2MnO4在碱性条件下发生歧化反应,产生MnO2、KMnO4,根据得失电子守恒、电荷守恒、原子守恒,该反应的离子方程式为:3![]() +2H2O=2
+2H2O=2![]() +MnO2↓+4OH-;但若溶液液碱性过强,由于
+MnO2↓+4OH-;但若溶液液碱性过强,由于![]() 具有强的氧化性,会将溶液中的OH-氧化产生O2,
具有强的氧化性,会将溶液中的OH-氧化产生O2,![]() 被还原产生
被还原产生![]() ,该转化过程中发生反应的离子方程式为:4
,该转化过程中发生反应的离子方程式为:4![]() +4OH-=4
+4OH-=4![]() +O2↑+2H2O;
+O2↑+2H2O;
(4)①用石墨电极电解K2MnO4溶液,右侧电解连接电源正极,为阳极,在阳极上溶液中的![]() 失去电子发生氧化反应变为
失去电子发生氧化反应变为![]() ,使溶液逐渐变为紫色,电极反应式为:
,使溶液逐渐变为紫色,电极反应式为:![]() -e-=
-e-=![]() ;
;
②随着电解的进行,溶液逐渐由绿色变为紫色。但若电解时间过长,溶液颜色又会转变成绿色,可能原因是在阴极上溶液中的H+不断放电产生H2逸出,使溶液碱性增强,![]() 转化为
转化为![]() ,溶液颜色又由紫色逐渐转化为绿色;
,溶液颜色又由紫色逐渐转化为绿色;
③为避免该现象发生,改进装置的措施是:在两电极之间增加阳离子交换膜,阴极室用氢氧化钾溶液,阳极室用锰酸钾溶液,这样就可以避免碱性环境中![]() 转化为
转化为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案