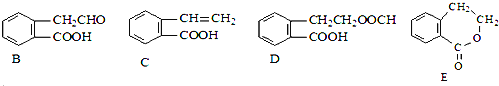
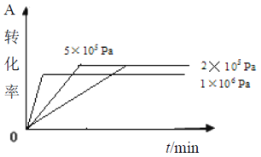
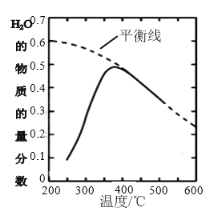
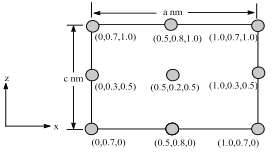
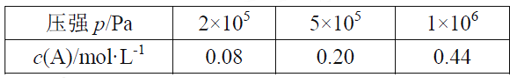题目内容
【题目】下列化学用语正确的是
A.(NH4)2 Fe(SO4)2 溶解于水:(NH4)2 Fe(SO4)2 ![]() 2NH4+ + Fe2 + + 2SO42-
2NH4+ + Fe2 + + 2SO42-
B.Al(OH)3在水中的电离:H+ + H2O+ AlO2-![]() Al(OH)3
Al(OH)3 ![]() Al3 ++3OH-
Al3 ++3OH-
C.H3PO4溶解于水:H3PO4 ![]() 3H+ + PO43-
3H+ + PO43-
D.NaHSO3在水中的电离:HSO3- + H2O ![]() SO32-+ H3O+
SO32-+ H3O+
【答案】B
【解析】
A. (NH4)2 Fe(SO4)2 为强电解质,溶解于水时完全电离:(NH4)2 Fe(SO4)2 =2NH4+ + Fe2 + + 2SO42-,与题意不符,A错误;
B. Al(OH)3为两性氢氧化物,在水中可发生酸式电离或碱式电离:H++ H2O+AlO2-![]() Al(OH)3
Al(OH)3![]() Al3++3OH-,符合题意,B正确;
Al3++3OH-,符合题意,B正确;
C. H3PO4为弱电解质,溶解于水发生分步电离:H3PO4![]() H++H2PO4-,H2PO4-
H++H2PO4-,H2PO4-![]() H++HPO42-,HPO42-
H++HPO42-,HPO42-![]() H++PO43-,与题意不符,C错误;
H++PO43-,与题意不符,C错误;
D. NaHSO3为强电解质,在水中的电离:NaHSO3=HSO3-+Na+,与题意不符,D错误;
答案为B。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目