题目内容
【题目】化学反应2A(g)+B(?)![]() 2C(g)达到化学平衡时:
2C(g)达到化学平衡时:
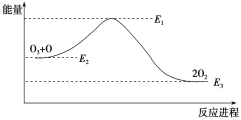
(1)升高温度时,C的量减少,则反应物的能量总和_____生成物的能量总和(填“>”、“<”或“=”)。
(2)如果增大压强,平衡向正反应方向移动,则B是_______态物质。
(3)若增加B的物质的量,平衡不移动,说明B是____________态物质。
【答案】> 气 固或液
【解析】
(1)升高温度时,C的量减少,说明平衡逆向移动,结合平衡移动原理判断反应的反应热,然后结合反应热与物质的能量变化关系分析判断;
(2)根据压强对化学平衡移动的影响分析判断物质的状态;
(3)反应物是气体会对平衡常数影响,若状态为非气态,则改变其物质的量,化学平衡不移动。
(1)升高温度时,生成物C的量减少,说明升高温度,化学平衡向逆向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,逆反应为吸热反应,因此该反应的正反应为放热反应,△H<0,说明反应物的能量比生成物的能量高,即反应物的能量总和>生成物的能量总和;
(2)根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动,如果增大压强,平衡向正反应方向移动,则正反应为气体体积减小的方向,由于A、C系数相等,都是气体,则反应物B的状态必为气态;
(3)若增加反应物B的物质的量,化学平衡不移动,说明B的状态不是气态,因此B的状态可能是液态,也可能是固态。
【点睛本题考查了外界条件对化学平衡移动的影响及物质含有的能量高低与反应热的关系。如果改变影响化学平衡的一个条件(浓度、温度、压强),化学平衡将向着减弱这种改变的方向移动,但不能抵消这种变化趋势。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目