��Ŀ����
����Ŀ�����ܺͼ��Ž����Ѻ������ı�Ȼѡ�ش��������⣺
(1)��֪��һ���¶��£���C(s)+CO2(g) ![]() 2CO(g) ��H1=a kJ��mol-1 ƽ�ⳣ��K1��
2CO(g) ��H1=a kJ��mol-1 ƽ�ⳣ��K1��
��CO(g)+H2O(g) ![]() H2(g)+CO2(g) ��H2=b kJ��mol-1 ƽ�ⳣ��K2��
H2(g)+CO2(g) ��H2=b kJ��mol-1 ƽ�ⳣ��K2��
ij��Ӧ��ƽ�ⳣ������ʽK3= ![]() ����д���˷�Ӧ���Ȼ�ѧ����ʽ______________��K1��K2��K3֮��Ĺ�ϵ��_____________��
����д���˷�Ӧ���Ȼ�ѧ����ʽ______________��K1��K2��K3֮��Ĺ�ϵ��_____________��
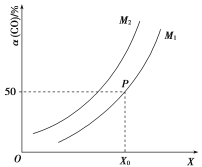
(2)��ԭ������n(CO2)��n(H2)=1��4�����ܱ������з���CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)��Ӧ�����H2O(g)�����ʵ����������¶ȵĹ�ϵ����ͼ��ʾ��
CH4(g)+2H2O(g)��Ӧ�����H2O(g)�����ʵ����������¶ȵĹ�ϵ����ͼ��ʾ��
���÷�Ӧ��ƽ�ⳣ��K���¶Ƚ��Ͷ�________�������С������
�����ܱպ��£�����100��������װ���н��и÷�Ӧ���ﵽƽ��״̬����________��
a����������ܶȲ��ٸı� b���������ѹǿ���ٸı�
c���������ƽ��Ħ���������ٸı� d��n(CO2)��n(H2)=1:2
��200���ﵽƽ��ʱ��ϵ����ѹǿΪP���÷�Ӧƽ�ⳣ��Kp�ļ������ʽΪ______�����ػ�����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
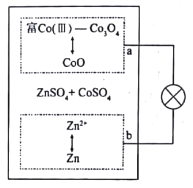
(3)500��ʱ��CO��ˮ��Ӧ����CO2��H2���������õ�H2�Ĺ���ʾ��ͼ���£�

��������Ӧʽ��_______________________________________________��
����ϵ缫��Ӧʽ������K2CO3��Һ������ԭ��___________________��
���𰸡�C(s)+H2O(g) ![]() CO(g)+H2(g) ��H= (a+b) kJ��mol-1 K3= K1��K2 ���� bc
CO(g)+H2(g) ��H= (a+b) kJ��mol-1 K3= K1��K2 ���� bc ![]() 2H2O-4e-=O2+4H+ ������Ӧ��2H2O+2e-=H2��+2OH-��OH-+HCO3-=CO32-+H2O��ʹK2CO3��Һ��������
2H2O-4e-=O2+4H+ ������Ӧ��2H2O+2e-=H2��+2OH-��OH-+HCO3-=CO32-+H2O��ʹK2CO3��Һ��������
��������
(1) ƽ�ⳣ��Ϊ�������Ũ����֮�����Է�Ӧ���Ũ����֮����ƽ�ⳣ���У�����Ϊ�������ĸΪ��Ӧ��������㶨�ɷ������⣻����ƽ�ⳣ���ı���ʽ�ƶϣ�
(2)�ٸ���ƽ���߷������¶Ƚ��ͣ�H2O�����ʵ��������������¶Ƚ��������ڷ�Ӧ������У�
�ڸ���ƽ��״̬��������һ�����жϣ��ر�ע����������ܶ�Ϊ����![]() ����������ƽ����Է���������СΪ
����������ƽ����Է���������СΪ![]() ��
��
�۸��ݷ���ʽ����ƽ��ʱ����ֵķ�ѹ�������ѹƽ�ⳣ������ʽ���㣻
(3) CO2��H2��K2CO3��Һϴ�Ӻ��ݳ�H2��ͬʱ�õ�KHCO3��Һ�����ö��Ե缫���KHCO3��Һ��������H2���ɣ�������CO2��O2���ɡ�
(1)ij��Ӧ��ƽ�ⳣ������ʽK3=![]() ����������ΪCO��H2����Ӧ����H2O�����ԭ���غ��֪����һ�ַ�Ӧ����C����Ϊ��̬����˷�Ӧ�Ļ�ѧ����ʽΪC(s)+H2O(g)
����������ΪCO��H2����Ӧ����H2O�����ԭ���غ��֪����һ�ַ�Ӧ����C����Ϊ��̬����˷�Ӧ�Ļ�ѧ����ʽΪC(s)+H2O(g)![]() CO(g)+H2(g)����֪����C(s)+CO2(g)
CO(g)+H2(g)����֪����C(s)+CO2(g)![]() 2CO(g) ��H1=a kJ��mol-1ƽ�ⳣ��K1=
2CO(g) ��H1=a kJ��mol-1ƽ�ⳣ��K1=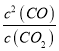 ����CO(g)+H2O(g)
����CO(g)+H2O(g)![]() H2(g)+CO2(g) ��H2=b kJ��mol-1ƽ�ⳣ��K2=
H2(g)+CO2(g) ��H2=b kJ��mol-1ƽ�ⳣ��K2=![]() �����ݸ�˹���ɣ���+�ڿɵ�C(s)+H2O(g)
�����ݸ�˹���ɣ���+�ڿɵ�C(s)+H2O(g)![]() CO(g)+H2(g)������H= (a+b) kJ��mol-1���ʸ÷�Ӧ�Ļ�ѧ����ʽΪC(s)+H2O(g)
CO(g)+H2(g)������H= (a+b) kJ��mol-1���ʸ÷�Ӧ�Ļ�ѧ����ʽΪC(s)+H2O(g)![]() CO(g)+H2(g) ��H= (a+b) kJ��mol-1��K3=
CO(g)+H2(g) ��H= (a+b) kJ��mol-1��K3=![]() =
=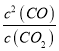 ��
��![]() =K1��K2��
=K1��K2��
(2)�ٸ���ƽ���߷������¶Ƚ��ͣ�H2O�����ʵ��������������¶Ƚ��������ڷ�Ӧ������У����Ը÷�Ӧ��ƽ�ⳣ��K���¶Ƚ��Ͷ�����
��a�����������ܶ�Ϊ����![]() ����Ӧǰ�������غ㣬��������m���䣬�����ݻ�V���䣬���Ի��������ܶ�ʼ�ղ��䣬����˵����Ӧ�Ƿ�ﵽ��ѧƽ�⣬������
����Ӧǰ�������غ㣬��������m���䣬�����ݻ�V���䣬���Ի��������ܶ�ʼ�ղ��䣬����˵����Ӧ�Ƿ�ﵽ��ѧƽ�⣬������
b����Ӧǰ������������ı䣬ѹǿ�仯������ͨ��ѹǿ�жϻ�ѧ��Ӧ�Ƿ�ﵽ��ѧƽ�⣬��b��ȷ��
c����������ƽ����Է���������СΪ![]() ����Ӧǰ��m���䣬n�ı䣬����ͨ����������ƽ����Է��������仯�жϻ�ѧ��Ӧ�Ƿ�ﵽ��ѧƽ�⣬��c��ȷ��
����Ӧǰ��m���䣬n�ı䣬����ͨ����������ƽ����Է��������仯�жϻ�ѧ��Ӧ�Ƿ�ﵽ��ѧƽ�⣬��c��ȷ��
d��CO2��H2�����ʵ���֮��ȡ���ڶ��ߵij������ͻ�ѧ��Ӧ����������ͨ��n(CO2)��n(H2)=1��2˵����ѧ��Ӧ�Ƿ�ﵽ��ѧƽ�⣬��d����
�ʴ�Ϊbc��
�۽�ԭ������n(CO2)��n(H2)=1��4�����ܱ������з���CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)��Ӧ������ȡ1molCO2��4molH2��
CH4(g)+2H2O(g)��Ӧ������ȡ1molCO2��4molH2��
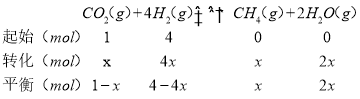
200��ﵽƽ��ʱH2O�����ʵ�������Ϊ0.6����![]() ��0.6���ɵ�x=
��0.6���ɵ�x=![]() ������ƽ����ϵ�У�p(CO2)=0.6p��p(CH4)=0.3p��p(CO2)=0.02p��p(H2)=0.08p����÷�Ӧƽ�ⳣ��Kp�ļ������ʽΪKp=
������ƽ����ϵ�У�p(CO2)=0.6p��p(CH4)=0.3p��p(CO2)=0.02p��p(H2)=0.08p����÷�Ӧƽ�ⳣ��Kp�ļ������ʽΪKp=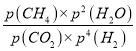 =
=![]() ��
��
(3)����������������Ӧ���缫��Ӧʽ��2H2O-4e-=O2+4H+��
�ڽ����ճ��е���Һ��⣬��������CO2��������O2����������K2CO3�����ʱH2O�ŵ����OH-��OH-��HCO3-��Ӧ����CO32-���ﵽ������Ŀ�ģ����Խ���Ϊ��������Ӧ��2H2O+2e-=H2��+2OH-��OH-+HCO3-=CO32-+H2O��ʹK2CO3��Һ����������

����Ŀ���뻯ѧƽ�����ƣ�����ƽ���ƽ�ⳣ�����������볣��(��K��ʾ)���±���ij�¶��¼��ֳ�������ĵ���ƽ�ⳣ����
�� | ���뷽��ʽ | ����ƽ�ⳣ��K |
CH3COOH | CH3COOH | 2��10��5 |
HClO | HClO | 3.0��10��8 |
H2CO3 | H2CO3 HCO3�� | K1=4.4��10��7 K2=5.61��10��11 |
H3PO4 | H3PO4 H2PO4�� HPO42�� | K1=7.1��10��3 K2=6.3��10��8 K3=4.2��10��13 |
�ش��������⣺
(1)����CH3COOH��HClO��H2CO3��HCO3����H3PO4��H2PO4����HPO42�����������ᣬ������������ǿ����_______(�ѧʽ����ͬ)����������________��
(2)��NaClO��Һ��ͨ�������Ķ�����̼�����������ӷ���ʽΪ_______��
(3)������¶��£�0.10molL��
(4)���¶���0.1mol/L��CH3COOH��Һ��ˮϡ���̣����б���ʽ������һ���������____��
A��c(H+) B��c(H+)c(CH3COO��) C��c(H+)c(OH��) D��c(OH��)/c(H+)
(5)ȡ�������pH��Ϊa�Ĵ���ʹ���������Һ���ֱ��õ�Ũ�ȵ�NaOHϡ��Һǡ���кͣ����ĵ�NaOH��Һ������ֱ�ΪV1��V2�����С��ϵΪ��V1_____V2( ��������������������=��)��
(6)�����������ӽ��H+������ǿ����_______��
A��HCO3�� B��CO32�� C��ClO�� D��CH3COO��
(7)�����ʵ����Ŀ����Ʒֱ���pHΪ2��3�Ĵ�����Һ�кͣ������Ĵ�����Һ���������ΪVa��Vb�������ߵĹ�ϵ��ȷ������_________��
A��Va��10Vb B��Va��10Vb C��Vb ��10 Va D��Vb��10Va