题目内容
【题目】下表是元素周期表的一部分
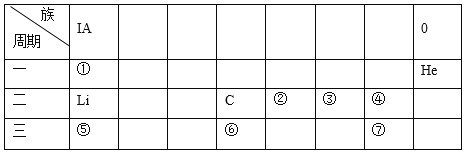
(1)表中非金属性最强的元素为__________(填写元素符号)。
(2)写出元素⑦最高价氧化物对应水化物的化学式___________。
(3)表中元素③和⑤可以组成原子比例为1:1的物质,元素②可以组成一种常见的气体单质,请画出两种分子的电子式____________、____________。
(4)表中元素④⑦氢化物的稳定性由大到小的顺序为:__________ (填写化学式)。
(5)表中有一种元素的单质可作为半导体材料,它在元素周期表中的位置是________。
【答案】F HClO4 ![]()
![]() HF>HCl 第三周期ⅣA族
HF>HCl 第三周期ⅣA族
【解析】
由表中元素的位置,可确定①~⑦号元素分别为H、N、O、F、Na、Si、Cl。
(1)在元素周期表中,从左到右,元素的非金属性依次增强;从下往上,元素的非金属性依次增强,所以非金属性最强的元素位于元素周期表的左上角。
(2)元素⑦为Cl,位于第三周期ⅦA族,在最高价氧化物对应水化物中显+7价。
(3)元素③和⑤可以组成原子比例为1:1的物质,则其为Na2O2;元素②可以组成一种常见的气体单质,则其为N2。
(4)元素④⑦氢化物分别为HF、HCl,非金属性越强,其氢化物的稳定性越强。
(5)表中有一种元素的单质可作为半导体材料,它为硅。
(1)在元素周期表中,从左到右,元素的非金属性依次增强;从下往上,元素的非金属性依次增强,所以非金属性最强的元素位于元素周期表的左上角,其为F。答案为:F;
(2)元素⑦为Cl,位于第三周期ⅦA族,在最高价氧化物对应水化物中显+7价,其化学式为:HClO4。答案为:HClO4;
(3)元素③和⑤可以组成原子比例为1:1的物质,则其为Na2O2,电子式为![]() ;元素②可以组成一种常见的气体单质,则其为N2,电子式为
;元素②可以组成一种常见的气体单质,则其为N2,电子式为![]() 。答案为
。答案为![]() ;
;![]() ;
;
(4)元素④⑦氢化物分别为HF、HCl,非金属性越强,其氢化物的稳定性越强,则氢化物的稳定性由大到小的顺序为:HF>HCl。答案为:HF>HCl;
(5)表中有一种元素的单质可作为半导体材料,它为硅,它在元素周期表中的位置是第三周期ⅣA族。答案为:第三周期ⅣA族。

【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
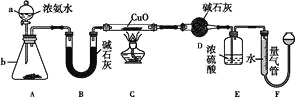
(1)仪器a的名称为____,仪器b中可选择的试剂为____。
(2)实验室中,利用装置A,还可制取的无色气体是____(填字母)。
A.Cl2 | B.O2 | C.CO2 | D.NO2 |
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体产生,上述现象证明NH3具有____性,写出相应的化学方程式:_______________________。
(4)E装置中浓硫酸的作用是_____________________________________。
(5)读取气体体积前,应对装置F进行的操作:____________________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____(用含m、n字母的代数式表示)。