题目内容
【题目】目前,处理烟气中 SO2 常采用两种方法:碱液吸收法和水煤气还原法。
Ⅰ.碱液吸收法
25℃时,Kb(NH3·H2O)=1.8×10-5;H2SO3:Ka1=1.5×10-2,Ka2=1.0×10-7;Ksp(CaSO4)=7.1×10-5。
第1步:用过量的浓氨水吸收 SO2,并在空气中氧化;
第2步:加入石灰水,发生反应 Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3·H2O K。
(1)25℃时,0.1 mol·L-1(NH4)2SO3 溶液的 pH_____(填“>”“<”或“=”)7。
(2)计算第2步中反应的 K=_____。
Ⅱ.水煤气还原法
已知:①2CO(g)+SO2(g)=S(l)+2CO2(g) ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)=S(l)+2H2O(g) ΔH2=+45.4 kJ·mol-1
③CO 的燃烧热ΔH3=-283 kJ·mol-1
(3)表示液态硫(S)的燃烧热的热化学方程式为_________。
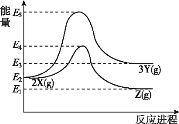
(4)反应②中,正反应活化能 E1_____(填“>”“<”或“=”)ΔH2。
(5)在一定压强下,发生反应①。平衡时SO2的转化率α(SO2)与投料比的比值[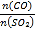 =y]、温度 T 的关系如图所示。
=y]、温度 T 的关系如图所示。
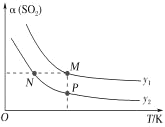
比较平衡时CO的转化率α(CO):N_____M。逆反应速率:N_____P(填“>”“<”或“=”)。
(6)某温度下,向10L恒容密闭容器中充入2molH2、2 molCO和2molSO2发生反应①、②,第5min时达到平衡,测得混合气体中CO2、H2O(g)的物质的量分别为1.6 mol、1.8 mol。
①该温度下,反应②的平衡常数K为_____。
②其他条件不变,在第 7 min 时缩小容器体积,SO2的平衡浓度_____(填“增大”“减小”或“不变”)。
【答案】> 4.3×1013 S(l)+O2(g)=SO2(g) ΔH=-529 kJ·mol-1 > > < 2700 增大
【解析】
(1)根据Kb(NH3H2O)=1.8×10-5>Ka2(H2SO3)=1.0×10-7,分析判断;
(2)第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3H2O,化学平衡常数K=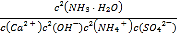 ,结合电离平衡常数和溶度积常数分析计算;
,结合电离平衡常数和溶度积常数分析计算;
(3)根据盖斯定律分析解答;
(4)根据焓变△H2=E1-E2结合反应②为吸热反应分析判断;
(5)反应①的正反应是气体体积减小的放热反应,温度相同、投料比的比值[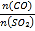 =y]越大,SO2的转化率α越大;投料比相同时,温度越高,SO2的转化率α越低,据此分析解答;
=y]越大,SO2的转化率α越大;投料比相同时,温度越高,SO2的转化率α越低,据此分析解答;
(6)①根据三段式结合平衡常数K=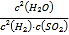 计算;②其他条件不变,在第7min时缩小容器体积,即使容器的压强增大,化学平衡正向移动,据此分析判断。
计算;②其他条件不变,在第7min时缩小容器体积,即使容器的压强增大,化学平衡正向移动,据此分析判断。
(1)由于Kb(NH3H2O)=1.8×10-5>Ka2(H2SO3)=1.0×10-7,根据盐的水解规律:“谁弱谁水解,谁强显谁性”可知,(NH4)2SO3溶液呈碱性,pH>7;故答案为:>;
(2)第2步:加入石灰水,发生反应Ca2++2OH-+2NH4++SO42-CaSO4↓+2NH3H2O 化学平衡常数K=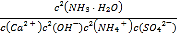 =
=![]() =
=![]() =4.3×1013,故答案为:4.3×1013;
=4.3×1013,故答案为:4.3×1013;
(3)①2CO(g)+SO2(g)S(l)+2CO2(g) △H1=-37.0kJ/mol,②2H2(g)+SO2(g)=S(l)+2H2O(g) △H2=+45.4kJ/mol,CO的燃烧热△H3=-283kJ/mol,即③CO(g)+![]() O2(g)=CO2(g) △H3=-283kJ/mol,根据盖斯定律③×2-①计算S(l)+O2(g)=SO2(g)的△H=(-283kJ/mol)×2 - (-37.0kJ/mol)=-529kJ/mol,热化学方程式为S(l)+O2(g)=SO2(g) △H=-529kJ/mol,故答案为:S(l)+O2(g)=SO2(g) △H=-529kJ/mol;
O2(g)=CO2(g) △H3=-283kJ/mol,根据盖斯定律③×2-①计算S(l)+O2(g)=SO2(g)的△H=(-283kJ/mol)×2 - (-37.0kJ/mol)=-529kJ/mol,热化学方程式为S(l)+O2(g)=SO2(g) △H=-529kJ/mol,故答案为:S(l)+O2(g)=SO2(g) △H=-529kJ/mol;
(4)反应②的正反应为吸热反应,焓变△H2=E1-E2(逆反应活化能)>0,E1=E2+△H2,由于E2>0,所以E1>△H2,故答案为:>;
(5)反应①的正反应是气体体积减小的放热反应,温度相同、投料比的比值[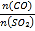 =y]越大,SO2的转化率α越大、CO的转化率越小,即y1>y2,投料比相同时,温度越高,SO2的转化率α越低,所以N点的投料比小、温度低,则CO的转化率大于M点CO的转化率;N、P投料比相同,但P点温度高,所以P点反应速率大于N点,逆反应速率:N<P,故答案为:>;<;
=y]越大,SO2的转化率α越大、CO的转化率越小,即y1>y2,投料比相同时,温度越高,SO2的转化率α越低,所以N点的投料比小、温度低,则CO的转化率大于M点CO的转化率;N、P投料比相同,但P点温度高,所以P点反应速率大于N点,逆反应速率:N<P,故答案为:>;<;
(6)①对于 2CO(g)+SO2(g)S(l)+2CO2(g)
开始(mol/L) 0.2 0.2 0
变化(mol/L) 0.16 0.08 0.16
平衡(mol/L) 0.04 0.12 0.16
对于2H2(g)+SO2(g)
开始(mol/L) 0.2 0.12 0
变化(mol/L) 0.18 0.09 0.18
平衡(mol/L) 0.02 0.03 0.18
所以反应②的化学平衡常数K=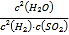 =
=![]() =2700,故答案为:2700;
=2700,故答案为:2700;
②其他条件不变,在第7min时缩小容器体积,即使容器的压强增大,由于两个反应的正反应都是气体体积减小的反应,所以缩小体积,容器的压强增大,化学平衡正向移动,二氧化硫的物质的量减小,但由于容器体积减小,所以二氧化硫的浓度仍然会增大,故答案为:增大。