题目内容
【题目】SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法、吸收法或电解法处理SO2。利用催化还原 SO2法 不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)已知CH4和S的燃烧热(△H)分别为-890.3 kJ/ mol和一297.2 kJ/ mol , 则CH4 催化还原SO2反应:CH4(g) +2 SO2 (g) =CO2(g)+ 2S(s)+ 2 H2O(1) △H =_____kJ/mol
(2)在恒容密闭容器中,用 H2还原SO2生成S 的反应分两步完成(如图1所示),该过程中相关物质的物质的量浓度随时间的变化关系如图2所示 :
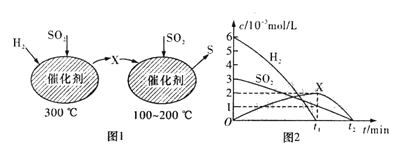
分析可知X为_______(填化学式),o~t1时间段的温度为_______,o~ t1时间段用SO2表示的化学反应速率为______________。
(3)焦炭催化还原SO2生成S2, 化学方程式为2C(s)+ 2 SO2 (g)![]() S2(g)+2CO2(g)△H < 0。
S2(g)+2CO2(g)△H < 0。
实验测得:v正= k 正c2 (SO2 ) , v逆= k 逆c(S2 ) c2 ( CO 2) ( k正、k逆为速率常数,只与温度有关).某温度下,向2L的恒容密闭容器中充入lmol SO2,并加入足量焦炭,当反应达平衡时,SO2 转化率为80%,则:
①k正:k 逆=_______________。
②若升高温度,k正增大的倍数______( 填“> ”、“< ”或“= ”) k 逆增大的倍数。
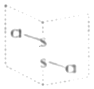
(4) 利用如图所示装置(电极均为惰性电极)可吸收SO2。
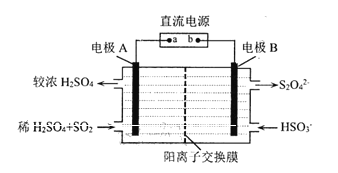
直流电源a为_______极,电解时.电极B的电极反应式为_____________。
【答案】-295.9kJ/mol H2S 300℃ ![]() mol/(Lmin) 3.2:1 < 正 2HSO3-+2H++2e-═S2O42-+2H2O
mol/(Lmin) 3.2:1 < 正 2HSO3-+2H++2e-═S2O42-+2H2O
【解析】
(1)CH4和SO2反应的化学方程式为CH4+2SO2=CO2+2S+2H2O,CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,热化学方程式为:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ②S(s)+O2(g)═SO2(g)△H=-297.2kJ/mol,根据盖斯定律①-②×2计算CH4(g)+2SO2(g)═CO2(g)+2S(s)+2H2O(l)的焓变△H;
(2)根据图1可知,在300℃时,SO2和H2反应生成H2S,在100℃到200℃时,H2S和SO2反应生成S和水;0~t1时间段用SO2 表示的化学反应速率v=![]() ;
;
(3) 某温度下,向2L的恒容密闭容器中充入lmol SO2,并加入足量焦炭,当反应达平衡时,SO2 转化率为80%,则:
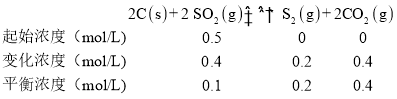
①当反应达到平衡时,v正=v逆,据此计算k正:k 逆;
②升高温度,正、逆反应速率均升高,且平衡向吸热反应方向移动;
(4) 依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,阳极区发生反应SO2-2e-+2H2O═SO42-+4H+,阳极与电源的正极a相连,b为电源负极,阴极的电极反应式为2HSO3-+2H++2e-═S2O42-+2H2O,以此解答该题。
(1)CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,可知热化学方程式:①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol,②S(s)+O2(g)═SO2(g)△H=-297.2kJ/mol,根据盖斯定律①-②×2可得CH4(g)+2SO2(g)═CO2(g)+2S(s)+2H2O(l)△H=-295.9kJ/mol;
(2)根据图1可知,在300℃时,SO2和H2反应生成H2S,在100℃到200℃时,H2S和SO2反应生成S和水,所以X为H2S;在图2中,0~t1时间段SO2和H2的浓度降低,H2S的浓度升高,故0~t1时间段温度为300℃;用SO2 表示的化学反应速率v=![]() =
=![]() =
=![]() mol/(Lmin);
mol/(Lmin);
(3) 某温度下,向2L的恒容密闭容器中充入lmol SO2,并加入足量焦炭,当反应达平衡时,SO2 转化率为80%,则:
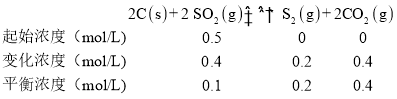
①当反应达到平衡时,v正=v逆,则k正c2 (SO2 ) =k逆c(S2)c2(CO2),故k正:k逆=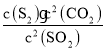 =
=![]() =3.2:1;
=3.2:1;
②此反应正反应为放热反应,则升高温度,平衡逆向移动,此时v正<v逆,则k正增大的倍数小于k逆增大的倍数;
(4) 依据图示可知,二氧化硫被氧化为硫酸根,所以二氧化硫所在的区为阳极区,则电源a为正极;电解时,电极B为阴极,HSO3-还原为S2O42-,则发生的电极反应式为2HSO3-+2H++2e- ═S2O42-+2H2O。

【题目】Ⅰ.已知某可逆反应:aA(g)+bB(g) ![]() cC(g)+dD(g)。请回答下列问题:
cC(g)+dD(g)。请回答下列问题:
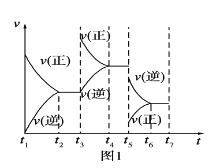
(1)根据实验测定结果,描绘出了该反应达到平衡状态时及改变外界条件后,反应速率与时间的关系图像(如图1所示),有利于提高D产量的变化过程是图像中的______段;引起该变化过程的外界条件是_________________________________________。
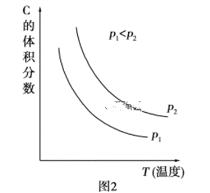
(2)根据实验测定结果描绘出了图2。由此图像可以得出,升高温度,上述平衡将向____(填“正反应”或“逆反应”)方向移动;反应计量数之间的关系:a+b______c+d(填“大于”、“小于”、“等于”或“不确定”)。
Ⅱ.工业合成氨反应如下:N2+3H2![]() 2NH3。请回答下列问题:
2NH3。请回答下列问题:
(1)在一定条件下2L的密闭容器中进行实验,并测得下列数据:
物质 | N2 | H2 | NH3 |
起始(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则10s内,用氢气表示的化学反应速率是______,该反应的化学平衡常数是________。
(2)根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是________,从而达到反应气体循环利用的目的。实验室检验氨气的方法是__________。