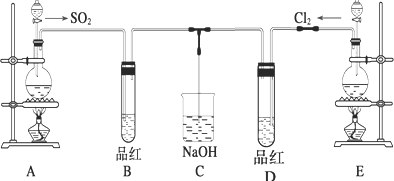
题目内容
11.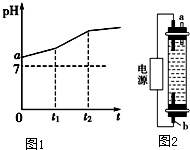 用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.(1)在0→t1时间内,两个电极上的电极反应式为:
阳极2Cl--2e-=Cl2↑ 阴极2H2O+2e-=H2↑+2OH-
(2)用离子方程式表示:a点pH>7原因:NaHCO3中HCO3-水解能力大于电离能力而导致溶液呈碱性
0→t1时间内,溶液pH升高比较缓慢的原因:碳酸钠水解能力大于碳酸氢钠导致溶液碱性增强但水解程度仍然不大
(3)从原溶液中溶质数量变化角度上看,t1时刻的意义是:说明该时刻生成的NaOH恰好将NaHCO3完全转化为Na2CO3,溶液中的溶质为NaCl、Na2CO3
(4)有人利用电解原理开发出了一种家用“84”消毒液(有效成分为NaClO)发生器(构造如图2),在制备该消毒液时,a电极应该连接在电源的负极上,电极反应式为:2H2O+2e-=H2↑+2OH-
若两个电极一种是铁、一种是石墨,则b极材料是石墨,电极反应式为:2Cl--2e-=Cl2↑.
分析 (1)在0→t1时间内,阳极上Cl-放电生成Cl2,阴极上H2O放电生成H2,同时阴极附近有OH-生成,阴极附近发生的反应为OH-+HCO3-=CO32-+H2O,导致溶液pH升高;
(2)a点溶液中溶质为NaCl与NaHCO3,NaHCO3中HCO3-水解能力大于电离能力而导致溶液呈碱性;0→t1时间内,生成的OH-和HCO3-反应生成CO32-,碳酸钠水解能力大于碳酸氢钠导致溶液碱性增强但水解程度仍然不大;
(3)0→t1时间内,溶液中的溶质先是NaCl与NaHCO3,随着电解的进行,溶液中n(NaCl)、n(NaHCO3)减少、n(Na2CO3)增加,t1时刻时,生成的NaOH恰好将NaHCO3完全转化为Na2CO3;
(4)电解氯化钠溶液制取NaClO溶液,阳极上生成Cl2,阴极上生成H2,同时阴极附近有NaOH生成,生成的Cl2和NaOH反应生成NaClO,为了Cl2和NaOH充分接触,生成的Cl2应该通过溶液和NaOH反应,所以b电极上生成Cl2,a电极上生成H2,阳极上应该用石墨作电极,阴极上用Fe作电极.
解答 解:(1)在0→t1时间内,阳极上Cl-放电生成Cl2,阴极上H2O放电生成H2,同时阴极附近有OH-生成,阴极附近发生的反应为OH-+HCO3-=CO32-+H2O,导致溶液pH升高,阳极、阴极反应式分别为:2Cl--2e-=Cl2↑、2H2O+2e-=H2↑+2OH-,
故答案为:2Cl--2e-=Cl2↑;2H2O+2e-=H2↑+2OH-;(2)a点溶液中溶质为NaCl与NaHCO3,NaHCO3中HCO3-水解能力大于电离能力而导致溶液呈碱性,所以溶液的pH>7;0→t1时间内,生成的OH-和HCO3-反应生成CO32-,碳酸钠水解能力大于碳酸氢钠导致溶液碱性增强但水解程度仍然不大,所以0→t1时间内,溶液pH升高比较缓慢,
故答案为:NaHCO3中HCO3-水解能力大于电离能力而导致溶液呈碱性;碳酸钠水解能力大于碳酸氢钠导致溶液碱性增强但水解程度仍然不大;
(3)0→t1时间内,溶液中的溶质先是NaCl与NaHCO3,随着电解的进行,溶液中n(NaCl)、n(NaHCO3)减少、n(Na2CO3)增加,t1时刻时,生成的NaOH恰好将NaHCO3完全转化为Na2CO3,溶液中的溶质为NaCl、Na2CO3,
故答案为:说明该时刻生成的NaOH恰好将NaHCO3完全转化为Na2CO3,溶液中的溶质为NaCl、Na2CO3;
(4)电解氯化钠溶液制取NaClO溶液,阳极上生成Cl2,阴极上生成H2,同时阴极附近有NaOH生成,生成的Cl2和NaOH反应生成NaClO,为了Cl2和NaOH充分接触,生成的Cl2应该通过溶液和NaOH反应,所以b电极上生成Cl2,a电极上生成H2,阳极上应该用石墨作电极,阴极上用Fe作电极,则a是阴极、b是阳极,
a连接电源负极、b连接电源正极,a电极反应式为2H2O+2e-=H2↑+2OH-,b电极材料是石墨,电极反应式为2Cl--2e-=Cl2↑,
故答案为:负;2H2O+2e-=H2↑+2OH-;石墨;2Cl--2e-=Cl2↑.
点评 本题考查了电解原理,为高频考点,明确各个电极上发生的反应是解本题关键,难点是判断(4)题中阴阳极,要结合生产实际分析解答,易错点是电极反应式的书写,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 硫原子的原子结构示意图: | |
| B. | NH4Cl的电子式: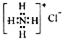 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm为不同的核素,有不同的化学性质 | |
| D. | 在固态水中,水分子间以氢键结合成排列规整的晶体,在这种晶体中有空隙,造成体积膨胀,密度减小至低于水的密度 |
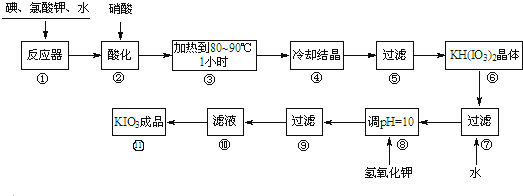
试回答下列问题:
(1)步骤①反应器发生的反应中,转移电子总数为60e-;
(2)步骤②中,用硝酸而不用HI,其原因可能是HI具有还原性,能将已生成的碘酸氢钾还原;
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为Cl2及Cl2与KOH反应生成的KClO,能将KIO3氧化成KIO4;
(4)实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有漏斗、烧杯、玻璃;
(5)步骤⑧用氢氧化钾调节溶液的pH,反应的化学方程式为:KOH+KH(IO3)2=2KIO3+H2O;
(6)参照下表碘酸钾的溶解度,步骤
 得到碘酸钾晶体,你建议的方法是蒸发结晶.
得到碘酸钾晶体,你建议的方法是蒸发结晶.| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3 g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
| A. | Li2C2水解生成C2H4 | B. | Al4C3水解生成丙炔 | ||
| C. | Mg2C3水解生成丙烯 | D. | ZnC2水解生成C2H2 |
| A. | C3H8、C2H5Br | B. | C4H10、C3H2Cl6 | C. | C5H12、C2H6O | D. | C6H14、C2H4O2 |
| A. | 它们相差一个电子层 | B. | 它们都有强还原性 | ||
| C. | 钠原子、钠离子均为同一元素 | D. | 灼烧时,它们的焰色反应都呈黄色 |