题目内容
1.将一定量N2和H2(体积比为1:3)的混合气体通入温度、体积不变的密闭容器中.一段时间后,容器内的压强是反应前的0.9倍,则此时N2的体积分数为22.2%.分析 设出氮气和氢气的体积,然后根据反应前后容器内压强关系判断反应中气体体积变化,利用差量法计算出反应消耗氮气的体积,从而可计算出反应后气体总体积及剩余氮气体积,最后计算出氮气的体积分数.
解答 解:N2和H2的体积比为1:3,设氮气的体积为VL,氢气的体积为3VL,气体总体积为4V,
温度和容器的体积不变的条件下,一段时间后容器内的压强是反应前的0.9倍,则反应后气体体积减少了:0.1×4VL=0.4VL,反应后气体总体积为:4V-0.4V=3.6V,则:N2+3H2?2NH3 △V
1 3 2 2
0.2VL 0.4VL
反应后混合气体中氮气的体积分数为:$\frac{VL-0.2VL}{3.6VL}$×100%=22.2%,
故答案为:22.2%.
点评 本题考查了混合物反应的计算,题目难度中等,根据压强变化计算出反应中气体体积变化为解答关键,注意掌握差量法在化学计算中的应用方法.

练习册系列答案
相关题目
11.有关有机化合物分子式或结构的测定,下列叙述不合理的是( )
| A. | 根据燃烧产物中元素的种类可以确定有机化合物中所含元素的种类 | |
| B. | 利用质谱仪记录的质谱图可以精确测定该有机化合物的相对分子质量 | |
| C. | 利用红外光谱仪记录的红外光谱图可以初步推测有机化合物中官能团类别 | |
| D. | 利用核磁共振仪记录的核磁共振氢图可以确定该有机化合物中氢原子的类型 |
9.短周期元素X、Y、Z、W的原子序数一次增大,X与Z、Y与W分别处于同一主族.X可分别与其他三种元素形成化合物.Z为同周期内原子半径最大的元素(稀有气体元素除外).Z、Y形成的某化合物跟Z、W形成的某化合物的摩尔质量相等.下列说法正确的是( )
| A. | 四种元素的最高正化合价都等于其所在的族序数 | |
| B. | X与Y、X与W分别形成的简单阴离子对水的电离的影响相似 | |
| C. | Z2W溶液呈碱性的原因可表示为W2-+2H2O?H2W+2OH- | |
| D. | X与Y、Y与Z均可形成具有强氧化性的化合物 |
16.(1)将350mL 1mol•L-1 NaOH溶液逐滴滴入100mL 1mol•L-1 AlCl3溶液中.
(2)将100mL 1mol•L-1 AlCl3溶液逐滴滴入350mL 11mol•L-1 NaOH溶液中,结果是( )
(2)将100mL 1mol•L-1 AlCl3溶液逐滴滴入350mL 11mol•L-1 NaOH溶液中,结果是( )
| A. | 现象相同,生成Al(OH)3的量相同 | B. | 现象不同,生成Al(OH)3的量相同 | ||
| C. | 现象相同,生成Al(OH)3的量不同 | D. | 现象不同,生成Al(OH)3的量不同 |
8.足量下列物质,能跟Na2CO3溶液反应,但不会放出气体的是( )
| A. |  | B. | 醋酸 | C. | 盐酸 | D. |  |
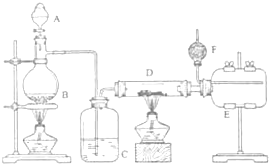 无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇 水后会发热并产生白雾.实验室用如图装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)→2A1Cl3+3H2.完成下列填空:
无水氯化铝是有机化工常用催化剂,其外观为白色固体,1780C时升华,极易潮解,遇 水后会发热并产生白雾.实验室用如图装置制备少量无水氯化铝,其反应原理为:2Al+6HCl(g)→2A1Cl3+3H2.完成下列填空: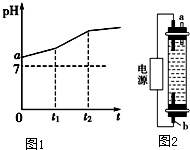 用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.