题目内容
4.下列条件的变化:①增大浓度,②增大压强,③升高温度,④使用催化剂,是因为增加单位体积内反应物分子中活化分子的百分数而使反应速率加快的是( )| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
分析 升高、加压、增大浓度、使用催化剂,只有温度、催化剂改变活化分子百分数.
解答 解:①增加反应物浓度,活化分子数目增大,但百分数不变,故不选;
②增大压强,活化分子数目增大,但百分数不变,故不选;
③升高温度,活化分子百分数增大,故选;
④使用催化剂,活化分子百分数增大,故选;
故选:B.
点评 本题考查影响反应速率的因素,注意活化分子数目与百分数的差别,明确温度、浓度、压强对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
19.在下列操作中,所使用的仪器能够达到目的是( )
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用托盘天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度可以比水大也可以比水小 |
9.短周期元素X、Y、Z、W的原子序数一次增大,X与Z、Y与W分别处于同一主族.X可分别与其他三种元素形成化合物.Z为同周期内原子半径最大的元素(稀有气体元素除外).Z、Y形成的某化合物跟Z、W形成的某化合物的摩尔质量相等.下列说法正确的是( )
| A. | 四种元素的最高正化合价都等于其所在的族序数 | |
| B. | X与Y、X与W分别形成的简单阴离子对水的电离的影响相似 | |
| C. | Z2W溶液呈碱性的原因可表示为W2-+2H2O?H2W+2OH- | |
| D. | X与Y、Y与Z均可形成具有强氧化性的化合物 |
16.(1)将350mL 1mol•L-1 NaOH溶液逐滴滴入100mL 1mol•L-1 AlCl3溶液中.
(2)将100mL 1mol•L-1 AlCl3溶液逐滴滴入350mL 11mol•L-1 NaOH溶液中,结果是( )
(2)将100mL 1mol•L-1 AlCl3溶液逐滴滴入350mL 11mol•L-1 NaOH溶液中,结果是( )
| A. | 现象相同,生成Al(OH)3的量相同 | B. | 现象不同,生成Al(OH)3的量相同 | ||
| C. | 现象相同,生成Al(OH)3的量不同 | D. | 现象不同,生成Al(OH)3的量不同 |
12.如果你家里的食用豆油混有一些水,你将采用下列何种方法分离( )
| A. | 过滤 | B. | 分液 | C. | 萃取 | D. | 蒸馏 |

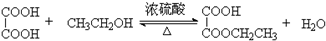 .
.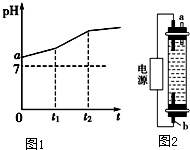 用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.
用惰性电极电解物质的量比为2:1的NaCl与NaHCO3混合溶液,溶液pH变化如图1所示.