��Ŀ����
����Ŀ��ijͬѧ��ͬ����Ԫ�����ʵݽ�����ʵ��ʱ���Լ������һ��ʵ�鷽��������¼���й�ʵ���������±���
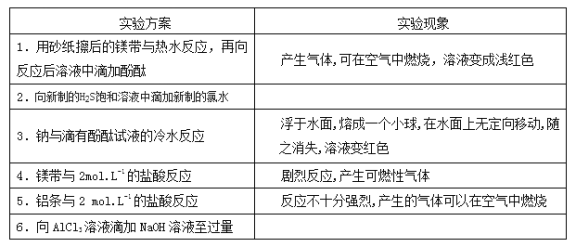
���������ͬѧ���������ʵ�鱨��
(1)ʵ��Ŀ�ģ���֤ͬ����Ԫ�ؽ����ԡ��ǽ����Եı仯���ɡ�
(2)ʵ����Ʒ���ԡ�
(3)ʵ�����ݣ�����д�����Ϣ������Ӧ��ʵ���������пո�д�����Ӧ�����ӷ���ʽ��
ʵ������ | ʵ������ | �й���������ʽ |
���� | ���� | |
�� | ______________ | ______________ |
���� | ______________ | |
�� | ���� | ���� |
�� | ���� | ______________ |
�� | ______________ | ______________ |
(4)ʵ����ۣ�______________��
(5)���������ۣ�
���ԭ�ӽṹ�����ϼ�˵�������������۵�ԭ����___________________��
���𰸡� ���ɵ���ɫ���� H2S��Cl2===2H����2Cl����S�� 2Na��2H2O===2Na����2OH����H2�� 2Al��6H��===2Al3����3H2�� ���ɰ�ɫ��״��������������ʧ Al3+ +3NH3��H2O == Al(OH)3�� + 3NH4+ ͬ����Ԫ����ԭ������������Ԫ�صĽ��������������ǽ���������ǿ ͬ����Ԫ�أ���˵���������ӣ�ԭ�Ӻ˶Ժ�����ӵ�����������ǿ��ԭ�Ӱ뾶��С��ԭ�ӵ�ʧ�����������������õ���������ǿ����Ԫ�ؽ��������������ǽ���������ǿ
����������3���������Ƶõ�Na2S��Һ���������Ƶ���ˮ��������Na2S����������ԭ��Ӧ�����ɵ���ɫ�ij�������Ӧ�����ӷ���ʽΪS2-+Cl2=2Cl-+S�����۽���������з�̪��Һ����ˮ���ҷ�Ӧ��Ѹ�ٲ���������ɫ���壬���ӷ���ʽΪ2Na +2H2O �� 2NaOH + H2�����ݽ�����Ͷ��ϡ�����У���Ӧ��ʮ�־��ң�������ɫ���壬�����ӷ�Ӧ����ʽΪ��2Al��6H��===2Al3����3H2���������Ȼ�����Һ�еμ�Ũ��ˮ��Һ���������������������������ڰ�ˮ��ʵ������Ϊ�����ɰ�ɫ��״��������������ʧ���䷴Ӧ�����ӷ���ʽΪ��Al3+ +3NH3��H2O == Al(OH)3�� + 3NH4+��
��4����ʵ�������֪������Na��Mg��Al��Ԫ�صĽ�����Խǿ����Ӧ�Ľ�������Խ���ã�Խ����ˮ���ᷴӦ����ӦԽ���ң����÷ǽ�������֮����û���Ӧ�Ƚ�Ԫ�صķǽ�����ǿ�����ǽ�����Cl��S����ͬ����Ԫ����ԭ������������Ԫ�صĽ��������������ǽ���������ǿ��
��5����ԭ�ӽṹ�ĽǶȷ�����ͬ����Ԫ�أ���˵���������ӣ�ԭ�Ӻ˶Ժ�����ӵ�����������ǿ��ԭ�Ӱ뾶��С��ԭ�ӵ�ʧ�����������������õ���������ǿ����Ԫ�ؽ��������������ǽ���������ǿ��



