题目内容
【题目】某溶液中大量存在五种离子:NO3-、SO42-、 Fe3+、H+、X,其物质的量之比为:n(NO3-)︰n(SO42-)︰n(Fe3+)︰n(H+)︰n(X)=2︰3︰1︰3︰1,则X可能为
A. Fe2+ B. Mg2+ C. Cl- D. Ba2+
【答案】B
【解析】试题分析:五种离子的物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(X)=2:3:1:3:1,由于溶液不显电性,但2×1+3×2>1×3+3×1,这说明X为阳离子。由电荷守恒可知,X所带2个正电荷。SO42-与Ba2+反应生成硫酸钡沉淀,在酸性溶液中硝酸根能氧化亚铁离子,所以X一定为Mg2+,答案选B。

练习册系列答案
相关题目
【题目】某同学做同周期元素性质递交规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
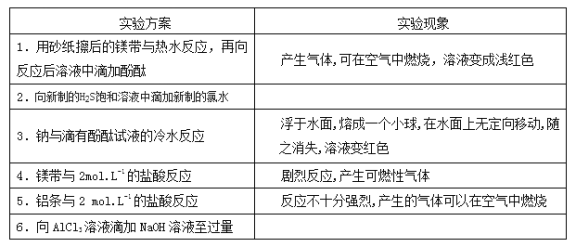
请你帮助该同学整理并完成实验报告
(1)实验目的:验证同周期元素金属性、非金属性的变化规律。
(2)实验用品:略。
(3)实验内容:(填写题给信息表中相应的实验现象,并在有空格处写出相对应的离子方程式)
实验方案 | 实验现象 | 有关离子方程式 |
不填 | 不填 | |
② | ______________ | ______________ |
不填 | ______________ | |
④ | 不填 | 不填 |
⑤ | 不填 | ______________ |
⑥ | ______________ | ______________ |
(4)实验结论:______________。
(5)问题与讨论:
请从原子结构理论上简单说明具有上述结论的原因是___________________。