��Ŀ����
����Ŀ������������(Na2S2O5)��һ��ʳƷ���Ӽ���ʵ��������ͼ1��ʾװ���Ʊ�Na2S2O5��ʵ�鲽�����£�

������Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ��
������̼���Ʒ�ĩ����pHΪ7��8��
������ͨSO2��pHΪ4.1��
�����ӹ�������Һ������Na2S2O5���壮
(1)�Ʊ������������ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
(2)Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ���� ���������вⶨ��Һ��pH�ķ����� ��pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ�� ��
(3)���õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ�����ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ(��ĥ��������ƿ)�У� ���ظ����ϲ���2�Σ���¼���ݣ�(ʵ���б���ʹ�õ��Լ��У�c1molL��1�ı�����Һ��c2molL��1�ı�Na2S2O3��Һ�������ᡢ������Һ������ˮ����֪��2Na2S2O3+I2�TNa2S4O6+2NaI)
(4)������ˮ�г��������۸�[Cr(��)]������Na2S2O5��FeSO47H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮ��ʵ������ͼ��
��ʵ���������Һ��pH�������ߵ�ԭ���� ��
����֪��Ksp[Cr(OH)3]=6.4��10��31��lg2��0.3��c(Cr3+)��1.0��10��5molL��1ʱ��Ϊ��ȫ�������ֽ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪ ��
���𰸡�Na2CO3+2SO2�TNa2S2O5+CO2Na2S2O5��ˮ��Ӧ����NaHSO3��NaHSO3��ˮ�е���ʹ��Һ��������pH�ƣ�����ȼƣ���pH���������ⶨNa2SO3����һ������Ĺ�����c1molL��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2molL��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ������Na2S2O5��FeSO47H2O��Cr2O72����Ӧʱ������H+��ʹ��Һ��pH���pH��5.6��
��������(1).�ɽ��������Ƶ��Ʊ����̿�֪�������Ķ��Ƿ�������ԭ��Ӧ����Ӧ����̼���ƺͶ�������������Ϊ���������ƺͶ�����̼�����������غ���ƽ��ɵã� Na2CO3+2SO2�TNa2S2O5+CO2
(2). Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ����Na2S2O5��ˮ��Ӧ����NaHSO3��NaHSO3��ˮ������ʹ��Һ�����ԣ��������вⶨ��Һ��pH�ķ�������pH�ƣ�����ȼƣ���pH���������ⶨ��pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ��Na2SO3 ��
(3). ���õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ������������ṩ���Լ��������ȼӹ����ı���Һ����������������Ϊ�����ƣ�Ϊ��ǿ��Һ�������ԣ�Ҫ���������ı�������õ�����ָʾ�����������������Һ�ζ������ĵ⣬���ݱ���Һ����������Ƶ�����������������Ƶĺ�������һ�����������+4��S�ĺ�������Ϊ�˼��ٵζ���Ҫ��������������ˮ��ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ�У�����һ������Ĺ�����c1molL��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2molL��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ���������ظ����ϲ���2�Σ���¼���ݣ�
(4). ��ʵ������з��������ӷ�ӦΪ��3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O��6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,������Һ��pH�������ߵ�ԭ����Na2S2O5��FeSO47H2O��Cr2O72����Ӧʱ������H+��ʹ��Һ��pH�����
���ɳ����ܽ�ƽ��Cr(OH)3![]() Cr3++3OH-��֪����Ϊc(Cr3+)��1.0��10��5molL��1ʱ��Ϊ��ȫ����,����c(OH-)>
Cr3++3OH-��֪����Ϊc(Cr3+)��1.0��10��5molL��1ʱ��Ϊ��ȫ����,����c(OH-)>![]() =
=![]() =4.0
=4.0![]() mol/L����pH>5.6�����Խ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪpH��5.6��
mol/L����pH>5.6�����Խ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪpH��5.6��

����Ŀ��ijͬѧ��ͬ����Ԫ�����ʵݽ�����ʵ��ʱ���Լ������һ��ʵ�鷽��������¼���й�ʵ���������±���
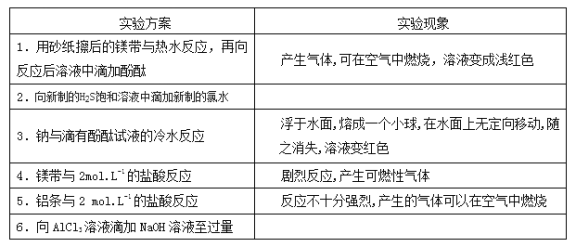
���������ͬѧ���������ʵ�鱨��
(1)ʵ��Ŀ�ģ���֤ͬ����Ԫ�ؽ����ԡ��ǽ����Եı仯���ɡ�
(2)ʵ����Ʒ���ԡ�
(3)ʵ�����ݣ�����д�����Ϣ������Ӧ��ʵ���������пո�д�����Ӧ�����ӷ���ʽ��
ʵ������ | ʵ������ | �й���������ʽ |
���� | ���� | |
�� | ______________ | ______________ |
���� | ______________ | |
�� | ���� | ���� |
�� | ���� | ______________ |
�� | ______________ | ______________ |
(4)ʵ����ۣ�______________��
(5)���������ۣ�
���ԭ�ӽṹ�����ϼ�˵�������������۵�ԭ����___________________��


