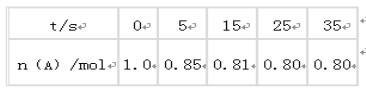
题目内容
【题目】金属铝质轻且有良好的防腐蚀性,在国防工业、生产、生活中具有非常重要的作用。下图是从铝土矿中制备铝的工艺流程:

已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3、MgO杂质;回答下列问题:
I、(1)铝土矿加入盐酸过滤后所得滤渣A的主要成分为____________。
(2)在工艺流程中,加入足量氢氧化钠溶液发生的离子反应共有_________个,其中发生沉淀溶解的离子反应方程式为____________。
(3)邋入过量的二氧化碳时,生成沉淀的离子方程式为____________。
(4)电解氧化铝,每生成1molA1时,生成____g氧气。
Ⅱ、测铝土矿组分的质量分数。
(1)若铝土矿样品质量为m,对滤渣A洗涤、干燥后称重为m1;对滤渣B洗涤、干燥、灼烧后称重为m2,该方案能测得质量分数的成份且相应的质量分数是____________;
(2)洗涤滤渣A后的洗涤液是否需加入到第一次过滤后的滤液中_____(“是”或“否”);检测滤渣A是否洗涤干净的方法是____________。
【答案】 SiO2 5 Al(OH)3 + OH- = [Al(OH)4]- [Al(OH)4]-+CO2==HCO3—+Al(OH)3↓ 24 SiO2:![]() ×100%;Al2O3:
×100%;Al2O3:![]() ×100%; 是 取最后一次洗涤液少许与试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净(或其它合理答案
×100%; 是 取最后一次洗涤液少许与试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净(或其它合理答案
【解析】I、(1)Fe2O3、Al2O3、MgO能溶于盐酸,滤渣A为SiO2;(2)在工艺流程中,加入足量氢氧化钠溶液,溶液中的H+、Fe3+、Al3+、Mg2+能与OH-反应:H++OH-=H2O、Fe3++ 3OH- = Fe(OH)3↓、Al3++ 3OH- = Al(OH)3↓、Mg2++ 2OH- = Mg(OH)2↓,然后在过量的氢氧化钠中氢氧化铝又溶解:Al(OH)3 + OH- = [Al(OH)4]-;发生的离子反应共有5个,其中发生沉淀溶解的离子反应方程式为Al(OH)3 + OH- = [Al(OH)4]-;(3)通入过量的二氧化碳时,[Al(OH)4]-转化为Al(OH)3沉淀,且生成HCO3—离子,其离子方程式为:[Al(OH)4]-+CO2==HCO3—+Al(OH)3↓;(4)根据化学方程式2Al2O3![]() 4Al+3O2↑可知,电解氧化铝,每生成1molA1时,生成氧气
4Al+3O2↑可知,电解氧化铝,每生成1molA1时,生成氧气![]() =24g;
=24g;
Ⅱ、(1) 滤渣A为SiO2,质量为m1,则质量分数为![]() ×100%;滤渣B是Fe(OH)3、Mg(OH)2,洗涤、干燥、灼烧后得Fe2O3、MgO,则铝土矿中Fe2O3、MgO质量之和为m2,故铝土矿中的质量为m- m1- m2,则质量分数为
×100%;滤渣B是Fe(OH)3、Mg(OH)2,洗涤、干燥、灼烧后得Fe2O3、MgO,则铝土矿中Fe2O3、MgO质量之和为m2,故铝土矿中的质量为m- m1- m2,则质量分数为![]() ×100%;(2)洗涤滤渣A后的洗涤液需加入到第一次过滤后的滤液中,否则测得的氧化铁和氧化镁的质量偏低,测得的铝土矿中的铝含量偏高;检测滤渣A是否洗涤干净的方法是取最后一次洗涤液少许与试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净。
×100%;(2)洗涤滤渣A后的洗涤液需加入到第一次过滤后的滤液中,否则测得的氧化铁和氧化镁的质量偏低,测得的铝土矿中的铝含量偏高;检测滤渣A是否洗涤干净的方法是取最后一次洗涤液少许与试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净。

【题目】某同学做同周期元素性质递交规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表:
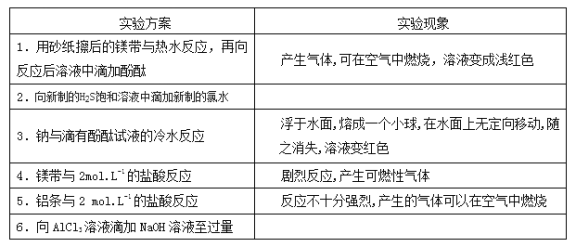
请你帮助该同学整理并完成实验报告
(1)实验目的:验证同周期元素金属性、非金属性的变化规律。
(2)实验用品:略。
(3)实验内容:(填写题给信息表中相应的实验现象,并在有空格处写出相对应的离子方程式)
实验方案 | 实验现象 | 有关离子方程式 |
不填 | 不填 | |
② | ______________ | ______________ |
不填 | ______________ | |
④ | 不填 | 不填 |
⑤ | 不填 | ______________ |
⑥ | ______________ | ______________ |
(4)实验结论:______________。
(5)问题与讨论:
请从原子结构理论上简单说明具有上述结论的原因是___________________。