题目内容
12.白藜芦醇属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用.某课题组提出了如下合成路线:
已知:RCH2Br$\stackrel{Li}{→}$R′$\stackrel{CH}{→}$O $\stackrel{H_{2}O}{→}$RCH2CH(OH)R′

根据以上信息回答下列问题:
(1)白藜芦醇的分子式是C14H12O3.
(2)C-→D的反应类型是取代反应;E-→F的反应类型是消去反应.
(3)化合物A不与FeCl3溶液发生显色反应,能与NaHCO3反应放出CO2,写出A-→B反应的化学方程式:
 .
.(4)写出化合物D、E的结构简式:D
 E
E .
.(5)化合物
 有多种同分异构体,写出符合下列条件的同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的同分异构体的结构简式: .
.①能发生银镜反应;②含苯环且苯环上只有两种不同化学环境的氢原子;
③含醇羟基.
分析 由于合成路线中唯一知道的是白黎芦醇的结构简式和分子式,因此可以以白黎芦醇的结构简式为起点,用逆推方法,确定各步反应的各物质的结构简式和反应类型,回答试题各问.也可根据有机物A的分子式C9H10O4,计算出A的不饱和度为5,再根据A不与FeCl3溶液发生显色反应,能与NaHCO3反应放出CO2等性质,结合白黎芦醇的结构简式,确定A的分子结构(含一个苯环,无酚羟基,有羧基.在苯环的间三位上有三个取代基等),推出有机物A的结构简式,用逆推(或顺推)方法,判断推出各有步反应的各物质的结构简式和反应类型: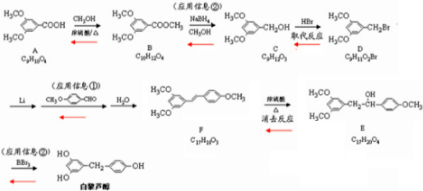 .
.
解答 解:用逆推(或顺推)方法,判断推出各有步反应的各物质的结构简式和反应类型:
(1)依据白黎芦醇的键线式,可写出分子:C14H12O3,故答案为:C14H12O3;
(2)C→D的反应类型是取代反应;E→F的反应类型是消去反应,故答案为:取代反应;消去反应;
(3)A为 ,与甲醇发生酯化反应生成B,B为
,与甲醇发生酯化反应生成B,B为 ,A→B反应的化学方程式为:
,A→B反应的化学方程式为: ,
,
故答案为: ;
;
(4)由以上分析可知,D的结构简式为: ,E的结构简式为:
,E的结构简式为: ,
,
故答案为: ;
; ;
;
(5)根据给定条件①能发生银镜反应,可确定分子结构中有醛基.②含苯环且苯环上只有两种不同化学环境的氢原子,可确定苯环上有二个取代基,并处于对位.③含醇羟基.则化合物 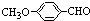 的同分异构体只有一种种:
的同分异构体只有一种种: ,
,
故答案为: .
.
点评 本题考查学生对有机化学基础的掌握情况,题目难度中等,试题以白黎芦醇的合成路线为素材,用给与信息的形式突出考核有机物结构(官能团)与性质的关系、各类衍生物间的转化关系及有机反应类型、同分异构体、化学方程式等基础知识.试题对知识要求和能力要求都较高.在解题时可以根据合成路线的各步反应,观察每步反应所列出的各物质化学式的规律,应用试题给予的信息和路线中各步反应的反应条件,找出各种物质间的转化关系,再运用已有的知识,判断推出出各有机物和有机反应类型.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | C3H6和C3H8O | B. | C3H4和C2H6 | C. | C3H6O2和C3H8O | D. | C4H6和C3H6O |
 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是( )| A. | x是正极,y是负极,CuSO4溶液的pH逐渐减小 | |
| B. | x是正极,y是负极,CuSO4溶液的pH保持不变 | |
| C. | x是负极,y是正极,CuSO4溶液的pH 逐渐减小 | |
| D. | x是负极,y是正极,CuSO4溶液的pH保持不变 |
| A. | 标准状况下,22.4LCl2与足量的NaOH溶液反应,转移电子总数为2NA | |
| B. | 标准状况下,22.4LH2O含有的分字数为NA | |
| C. | NA个氧气分子和NA个氢气分子的质量比是16:1 | |
| D. | 在32g O3分子中含有NA个O3分子 |
| A. | 1,2-二溴乙烷 | B. | 2,3-二甲基丁烷 | ||
| C. | 2-丁烯 | D. | 2-甲基-3-乙基丁烷 |


 如图1是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图.请认真读图分析,回答有关问题.
如图1是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图.请认真读图分析,回答有关问题.
