题目内容
11.已知H+(aq)+OH-(aq)═H2O(l)放出的57.3KJ.下列反应中放出57.3KJ热量的有( )①KHSO4(aq)+KOH(aq)═K2SO4(aq)+H2O(l)
②H2SO4(aq)+Ba(OH)2═BaSO4↓+2H2O(l)
③HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l)
④HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l)
⑤H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)
⑥CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l).
| A. | ①③ | B. | ③④ | C. | ④⑤ | D. | ②⑥ |
分析 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时的中和热为57.3kJ/mol,但是弱酸的电离吸热,浓硫酸的稀释会放热.
解答 解:25℃,101kPa时,强酸与强碱的稀溶液发生中和反应生成1mol水时的中和热为57.3kJ/mol,因醋酸是弱酸,电离过程需要吸热,所以反应放出的热小于57.3kJ,浓硫酸的溶解放热,所以反应放出的热大于57.3kJ,
①KHSO4(aq)+KOH(aq)═K2SO4(aq)+H2O(l),等于57.3KJ,故正确;
②H2SO4(aq)+Ba(OH)2═BaSO4↓+2H2O(l),生成2moL水,不等于57.3KJ,故错误;
③HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l),等于57.3KJ,故正确;
④HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l),因氨水是弱碱,电离过程需要吸热,不等于57.3KJ,故错误;
⑤H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l),生成2moL水,不等于57.3KJ,故错误;
⑥CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l),因醋酸是弱酸,电离过程需要吸热,不等于57.3KJ,故错误;
故选A.
点评 本题考查中和热,明确中和热是指强酸与强碱的稀溶液发生中和反应所放出的热量是解题关键,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
1.分别中和10mL1.0mol/L的HCl溶液,消耗了等体积的氢氧化钠溶液和氨水溶液,则氢氧化钠溶液和氨水溶液的关系是( )
| A. | 所含溶质质量相等 | B. | 所含溶质物质的量氨水多 | ||
| C. | 溶液物质的量浓度相等 | D. | 电离度相等 |
6.人体正常的血红蛋白应含Fe2+.若误食外表与食盐相近的亚硝酸盐,则导致血红蛋白中的Fe2+转化成Fe3+而中毒,服用维生素C可解除亚硝酸盐中毒,下列叙述中正确的是( )
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是还原剂 | ||
| C. | 维生素C是氧化剂 | D. | 亚硝酸盐被氧化 |
3.下列说法正确的是( )
| A. | 投入铁片产生H2的溶液中可大量存在H+,Mg2+,SO${\;}_{4}^{2-}$,NO${\;}_{3}^{-}$ | |
| B. | 可用稀硝酸除去试管内壁上的银镜 | |
| C. | 1.0mol•L-1的KNO3溶液中可大量存在H+,Fe2+,Cl-,SO${\;}_{4}^{2-}$ | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |
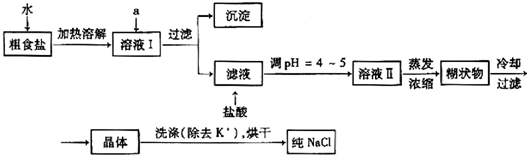
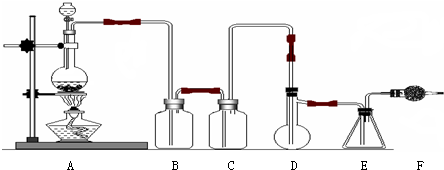
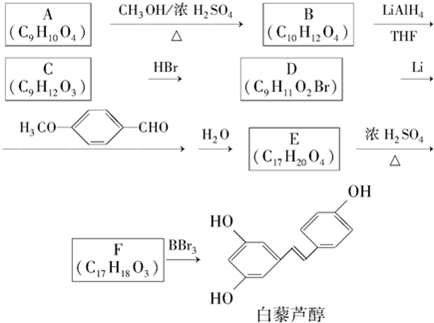
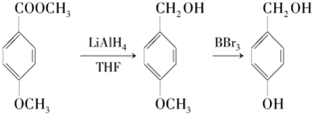
 .
.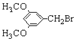 E
E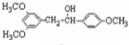 .
.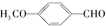 有多种同分异构体,写出符合下列条件的同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的同分异构体的结构简式: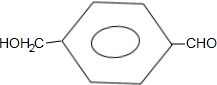 .
.