题目内容
4.设NA为阿伏伽德罗常数的数值 下列说法正确的是( )| A. | 标准状况下,22.4LCl2与足量的NaOH溶液反应,转移电子总数为2NA | |
| B. | 标准状况下,22.4LH2O含有的分字数为NA | |
| C. | NA个氧气分子和NA个氢气分子的质量比是16:1 | |
| D. | 在32g O3分子中含有NA个O3分子 |
分析 A、氯气与氢氧化钠的反应为歧化反应;
B、标况下,水为液态;
C、当两种物质的物质的量相同时,质量之比等于摩尔质量之比;
D、臭氧的摩尔质量为48g/mol.
解答 解:A、氯气与氢氧化钠的反应为歧化反应,1mol氯气转移1mol电子,即NA个,故A错误;
B、标况下,水为液态,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、NA个氧气分子和NA个氢气分子的物质的量均为1mol,而当两种物质的物质的量相同时,质量之比等于摩尔质量之比,故两者的质量之比为32:2=16:1,故C正确;
D、臭氧的摩尔质量为48g/mol,故32g臭氧的物质的量n=$\frac{32g}{46g/mol}$=$\frac{2}{3}$mol,即$\frac{2}{3}$NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 投入铁片产生H2的溶液中可大量存在H+,Mg2+,SO${\;}_{4}^{2-}$,NO${\;}_{3}^{-}$ | |
| B. | 可用稀硝酸除去试管内壁上的银镜 | |
| C. | 1.0mol•L-1的KNO3溶液中可大量存在H+,Fe2+,Cl-,SO${\;}_{4}^{2-}$ | |
| D. | 硫化铜溶于硝酸的离子方程式为CuS+2H+═H2S↑+Cu2+ |
15.将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)?xC(g)+2D(g),经4min后测得D的浓度为0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.125mol•L-1•min-1,下列说法正确的是( )
| A. | 反应速率v(B)=0.13 mol•L-1•min-1 | B. | 该反应方程式中,x=1 | ||
| C. | 4min时,A的物质的量为0.75mol | D. | 4min时,A的转化率为50% |
19.“化学是人类进步的关键”.下列说法正确的是( )
| A. | 用加酶洗衣粉洗衣服时,温度越高效果越好 | |
| B. | “神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 乙二醇可用来生产聚酯纤维和作汽车发动机的抗冻剂 |
9.电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,电极总反应为:Ag2O+H2O+Zn=Zn(OH)2+2Ag.下列叙述正确的是( )
| A. | Zn是正极,Ag2O是负极 | |
| B. | Zn是负极,Ag2O是正极 | |
| C. | 该电池可将化学能100%转化为电能 | |
| D. | 工作时电子由Zn极经溶液移向Ag2O极 |
16.磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料.某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂.其主要工艺流程如图:
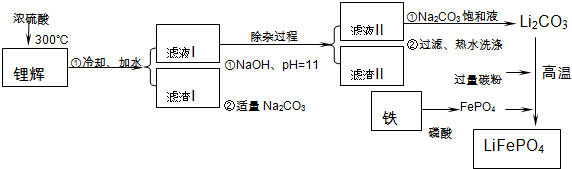
已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
(1)从滤渣Ⅰ中可分离出Al2O3,如下图所示.请写出生成沉淀的离子方程式Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
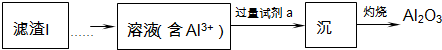
(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式).
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.

已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
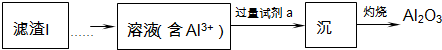
(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式).
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
13.下列叙述正确的是( )
| A. | 原子晶体中,共价键的键能越大,熔沸点越高 | |
| B. | 分子晶体中,分子间作用力越大,该分子越稳定 | |
| C. | 金属阳离子只能与阴离子构成晶体 | |
| D. | 正四面体构型的分子中,键角一定为109°28′ |
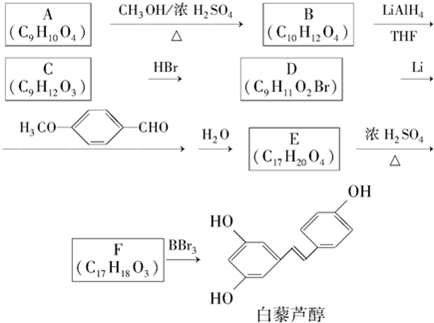
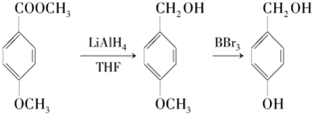
 .
.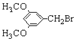 E
E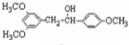 .
.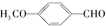 有多种同分异构体,写出符合下列条件的同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的同分异构体的结构简式: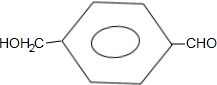 .
.