题目内容
1.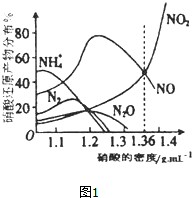 如图1是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图.请认真读图分析,回答有关问题.
如图1是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图.请认真读图分析,回答有关问题.(1)下列叙述中正确的是(填序号)BCD.
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小.
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已.
C.硝酸的浓度越大,还原产物中N元素低化合价产物越少.
D.当硝酸密度大于1.3g•cm-3时,还原产物主要为NO、NO2
(2)当硝酸溶液的密度为1.36g•cm-3时,Fe与过量硝酸反应的化学方程式是4Fe+18HNO3═4Fe(NO3)3+3NO↑+3NO2↑+9H2O.
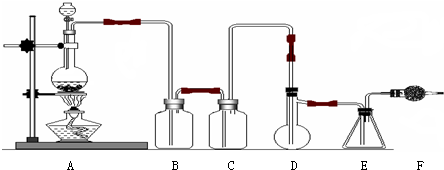
(3)限用下列仪器、药品验证由铁和过量1.36g•cm-3硝酸反应产生的气体中含有NO(不考虑N2O4).设计一个合理而简单的实验方案(如图2,仪器可选择使用,N2的用量可自由控制,加热装置和固定装置省略).
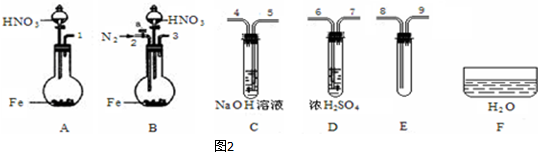
第1步:反应并收集生成的气体:
①实验中气体发生装置应选择B(填装置序号),理由是N2排除装置中的空气,以防NO被氧化.
②装置的连接顺序是(填各装置接口的序号):[3]→[6][7]→[8][9]→[5].
③检查装置气密性后,开始反应.待E中充满红棕色气体,停止实验.
第2步:验证E中有NO.
④取下试管E,倒立在F中,轻轻摇动试管.
确认生成的气体中有NO的现象是余气体积等于试管容积的三分之一.
(4)某工厂生产硝酸的流程简要表示如图3:
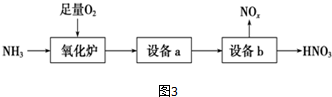
①氧化炉中反应的化学方程式为4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O.
②工业上通常用质量分数为15%的Na2CO3水溶液(密度1.16g•mL-1)作为NOx吸收剂,它的物质的量浓度为1.64 mol•L-1(保留2位小数).
分析 (1)从图中可以看出,当其他条件一致时,在浓硝酸(密度为1.40g•cm-3)中,主要产物NO2,随着硝酸浓度逐渐降低,产物NO2逐渐减少而NO的相对含量逐渐增多;当密度为1.25g•mL-1时,主要产物是NO,其次是NO2及少量的N2O;当密度为1.15g•mL-1时,NO与NH4+的相对含量几乎相等;当HNO3的浓度降到密度为1.05g•mL-1时,NH4+离子成为主要产物,凡有硝酸参加的氧化还原反应都比较复杂,往往同时生成多种还原产物;硝酸的密度越大、浓度越大,其还原产物中氮元素化合价越高;
(2)Fe与过量硝酸反应得到的含铁化合物是硝酸铁,不含硝酸亚铁;
(3)①根据NO易被氧化来分析;
②根据实验的目的和各部分的作用确定连接顺序;
④二氧化氮和水之间反应生成硝酸和一氧化氮;
(4)①氧化炉中反应为氧气的催化氧化,生成一氧化氮和水;
②根据c=$\frac{1000ρω}{M}$计算碳酸钠溶液物质的量浓度.
解答 解:(1)A.硝酸的密度越大、浓度越大,故A错误;
B.由图象可以看出,在相同温度和浓度时,硝酸的还原产物不止一种,以某种产物为主,故B正确;
C.由图象可以看出,还原产物中NH4+的物质的量分数随硝酸密度增大而减小,铵根离子中氮元素化合价最低是-3价,故C正确;
D、当硝酸溶液的密度为1.36g•mL-1时,由图象可看出,生成的NO和NO2物质的量相等,且硝酸密度大于1.3g•cm-3时,还原产物主要为NO、NO2,故D正确;
故选:BCD;
(2)当硝酸溶液的密度为1.36g•mL-1时,由图象可看出,生成的NO和NO2物质的量相等,且硝酸过量时,得到的含铁化合物是硝酸铁,不含硝酸亚铁,反应的化学方程式应为4Fe+18HNO3═4Fe(NO3)3+3NO↑+3NO2↑+9H2O,故答案为:4Fe+18HNO3=4Fe(NO3)3+3NO↑+3NO2↑+9H2O;
(3)①因NO易被氧化,若装置中存在氧气,则不能说明NO的存在,所以反应前先通入N2目的是排尽装置中的空气,防止NO被氧化,
故答案为:B;N2排除装置中的空气,以防NO被氧化;
②A中铁与浓硝酸反应NO2进入C浓硫酸干燥,然后进入F冰水混合物冷却使二氧化氮液化分离,剩余的NO进入D与氧气反应,最后连接尾气处理装置,所以仪器连接顺序为:3-6-7-8-9-5,
故答案为:3;6;7;5;
④二氧化氮和水之间反应生成硝酸和一氧化氮,即3NO2+H2O═2HNO3+NO,如果生成气体中含有一氧化氮,则试管中余气体积等于试管容积的三分之一;
故答案为:余气体积等于试管容积的三分之一;
(4)①氧化炉中反应为氧气的催化氧化,生成一氧化氮和水,方程式为:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O;
②该碳酸钠溶液物质的量浓度为$\frac{1000×1.16×0.15}{106}$mol/L=1.64mol/L,故答案为:1.64.
点评 本题综合考查学生含氮化合物的性质,注意知识的迁移与运用和应用是解题的关键,难度不大.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| A. | Zn是正极,Ag2O是负极 | |
| B. | Zn是负极,Ag2O是正极 | |
| C. | 该电池可将化学能100%转化为电能 | |
| D. | 工作时电子由Zn极经溶液移向Ag2O极 |
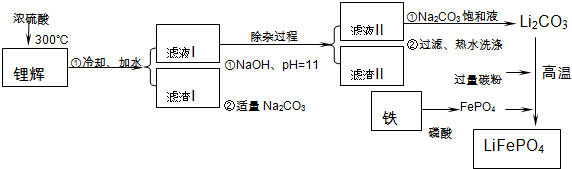
已知:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250~300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
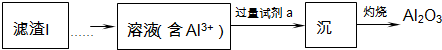
(2)滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3(填化学式).
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)写出在高温下生成磷酸亚铁锂的化学方程式2FePO4+Li2CO3+2C$\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑.
| A. | CH3CH2OH | B. | H2O | C. | CH3COOH | D. | C6H12O6 |
| A. | 原子晶体中,共价键的键能越大,熔沸点越高 | |
| B. | 分子晶体中,分子间作用力越大,该分子越稳定 | |
| C. | 金属阳离子只能与阴离子构成晶体 | |
| D. | 正四面体构型的分子中,键角一定为109°28′ |
| A. | 乙烯能使溴水和酸性高锰酸钾溶液褪色,其褪色原理相同 | |
| B. | 甲烷与氯气在光照条件下的反应属于置换反应 | |
| C. | 工业上可以通过乙烯与氯气发生加成反应制取氯乙烷 | |
| D. | 除去乙烷中的乙烯得到纯净的乙烷,可依次通过KMnO4(H+)溶液、NaOH溶液和H2SO4(浓) |
(1)烧杯中未溶物仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. |  |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 有白色沉淀生成,说明有Ba2+; |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中 | 试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3 |
| 步骤4:取适量滤液于烧杯中,用pH计测其pH值 | pH>9.6,说明有大量的OH-,综合上面步骤可知试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,假设成立. |
①配制250ml 约0.1mol•L-1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解、过滤,将溶液转入250mL容量瓶,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将
0.1980 (填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下,不能(填“能”或“不能”) 配制1.0mol•L-1Ba(OH)2溶液.
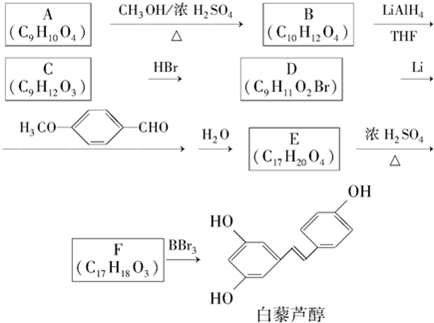
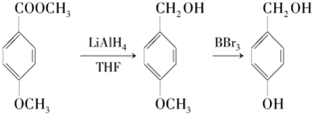
 .
.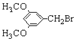 E
E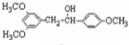 .
.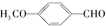 有多种同分异构体,写出符合下列条件的同分异构体的结构简式:
有多种同分异构体,写出符合下列条件的同分异构体的结构简式: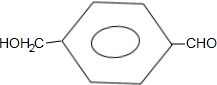 .
.