题目内容
5.已知CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ/molCH4(g)+CO2(g)═2CO(g)+2H2 (g)△H=+247kJ/mol
C-H键的键能约为413kJ/mol,O-H键的键能约为463kJ/mol,H-H键的键能约为436kJ/mol,则CO2中C=O键的键能约为( )
| A. | 797.5 kJ/mol | B. | 900.5 kJ/mol | C. | 962.5 kJ/mol | D. | 1595 kJ/mol |
分析 先依据盖斯定律,对热化学方程式计算得到CH4(g)+2H2O(g)═CO2(g)+4H2(g)的反应热,再结合反应热=断裂化学键吸收的能量-形成化学键放出的能量来解答.
解答 解:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206kJ/mol
②CH4(g)+CO2(g)═2CO(g)+2H2 (g)△H=+247kJ/mol
依据盖斯定律①×2-②得到:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165kJ/mol
设C=O键的键能为xkJ/mol,
+165=413×4+463×4-C=2x-436×4
解得:x=797.5
故选:A.
点评 本题考查盖斯定律、依据反应热计算化学键键能的方法,题目难度中等,侧重反应原理的考查.

练习册系列答案
相关题目
15.有关海带中碘元素的分离实验,下列说法中正确的是( )
| A. | 海带、紫菜等海藻类植物中含有丰富的I2 | |
| B. | 灼烧海带样品时,坩埚应该垫在石棉网上加热 | |
| C. | 可以用CCl4、裂化汽油等有机溶剂把碘萃取出来 | |
| D. | 分液漏斗中液体的总体积不得超过其容量的$\frac{2}{3}$ |
16.下列反应既是氧化还原反应,又是吸热反应的是( )
| A. | 锌粒与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 葡萄糖在人体内氧化 |
13.NA代表阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 常温常压下,6gNO2和40gN2O4混合气体中的原子总数为3NA | |
| B. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| C. | 在电解食盐水的实验中,测得阴极析出的气体的分子数为0.5NA,则电解后溶液的pH为14 | |
| D. | 64g的铜发生氧化还原反应,一定失去2NA个电子 |
20.在-CH3,-OH,-C6H5和-COOH四种基团中,不同基团两两组合成的化合物中,其水溶液能够与碳酸氢钠反应的有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
10.为检验Na2SO3溶液中是否含有Na2SO4应选用的试剂是( )
| A. | BaCl2溶液 | B. | 稀盐酸、BaCl2溶液 | ||
| C. | 稀硝酸、BaCl2溶液 | D. | 稀硫酸、BaCl2 |
17.某种氢氧燃料电池的电解液为KOH溶液,下列有关电池的叙述不正确的是( )
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| C. | 工作一段时间后,电解液中的KOH的物质的量不变 | |
| D. | 工作时溶液中K+向负极移动 |
14.为检验某溴代烃(R-Br)中的溴元素,进行如下操作,正确的顺序是①加热 ②加入AgNO3溶液 ③取少量该溴代烃 ④加入NaOH溶液 ⑤冷却后加入足量稀HNO3酸化( )
| A. | ③④①⑤② | B. | ③①④②⑤ | C. | ③②①⑤④ | D. | ③④①②⑤ |
15.下列反应过程中的能量变化情况符合如图的是( )
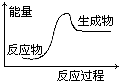

| A. | 酸与碱的中和反应 | B. | 镁和盐酸的反应 | ||
| C. | 氧化钙和水反应 | D. | 水发生分解反应 |