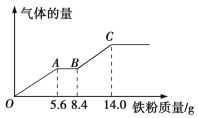
题目内容
【题目】二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(主要成分为![]() ,其中硫元素为
,其中硫元素为![]() 价)在高温条件下和氧气反应制备
价)在高温条件下和氧气反应制备![]() :
: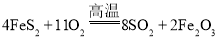 ,该反应中被氧化的元素是______(填元素符号)。当该反应转移
,该反应中被氧化的元素是______(填元素符号)。当该反应转移![]() 电子时,生成的二氧化硫在标准状况下的体积为______
电子时,生成的二氧化硫在标准状况下的体积为______![]() 。
。
(2)实验室中用下列装置测定![]() 被催化氧化为
被催化氧化为![]() 的转化率。(已知
的转化率。(已知![]() 的熔点为
的熔点为![]() ,假设气体进入装置时均被完全吸收,且忽略空气中
,假设气体进入装置时均被完全吸收,且忽略空气中![]() 的影响)
的影响)
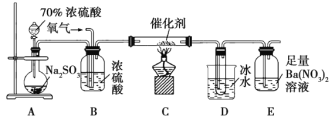
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:______。
②当停止通入![]() ,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是______。
③实验结束后,若装置![]() 增加的质量为mg,装置
增加的质量为mg,装置![]() 中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
中产生白色沉淀的质量为ng,则此条件下二氧化硫的转化率是______(用含字母的代数式表示,不用化简)。
(3)某学习小组设计了如图所示装置来验证二氧化硫的化学性质。
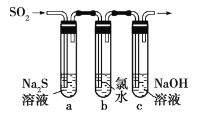
①能说明二氧化硫具有氧化性的实验现象为______。
②为验证二氧化硫的还原性,反应一段时间后,取试管![]() 中的溶液分成三份,分别进行如下实验。
中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入![]() 溶液,有白色沉淀生成
溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入![]() 溶液,产生白色沉淀
溶液,产生白色沉淀
上述方案合理的是______(填“Ⅰ”“Ⅱ”或“Ⅲ”);试管![]() 中发生反应的离子方程式为______。
中发生反应的离子方程式为______。
【答案】![]() 、
、![]()
![]() 打开分液漏斗上部的活塞,旋开分液漏斗的旋塞,缓慢滴加 使残留在装置中的
打开分液漏斗上部的活塞,旋开分液漏斗的旋塞,缓慢滴加 使残留在装置中的![]() 和
和![]() 被充分吸收
被充分吸收 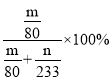 试管
试管![]() 中出现黄色浑浊 Ⅲ
中出现黄色浑浊 Ⅲ 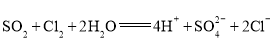
【解析】
(1)化合价升高的元素被氧化;
(2)①要使分液漏斗中的液体顺利滴下,要打开分液漏斗上的活塞;
②停止通入![]() ,装置中还残留没有被吸收的SO2和三氧化硫;
,装置中还残留没有被吸收的SO2和三氧化硫;
③D装置增加的质量是三氧化硫的质量,E中产生的白色沉淀是硫酸钡,则根据S原子守恒计算;
(3)①SO2具有氧化性,能把硫离子氧化生成单质S沉淀;
②氯水中含有氯离子,和硝酸银溶液一定生成白色沉淀;氯水具有强氧化性,能使品红溶液褪色;向第三份溶液加入BaCl2溶液,产生白色沉淀,白色沉淀一定是硫酸钡;
(1)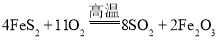 ,Fe元素化合价由+2升高为+3、S元素化合价由-1升高为+4,该反应中被氧化的元素是
,Fe元素化合价由+2升高为+3、S元素化合价由-1升高为+4,该反应中被氧化的元素是![]() 、
、![]() ;根据反应方程式
;根据反应方程式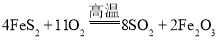 ,转移44mol电子生成8molSO2,当该反应转移
,转移44mol电子生成8molSO2,当该反应转移![]() 电子时,生成的二氧化硫的物质的量是
电子时,生成的二氧化硫的物质的量是![]() 0.5mol,在标准状况下的体积为11.2L。
0.5mol,在标准状况下的体积为11.2L。
(2)①要使分液漏斗中的液体顺利滴下,则要首先打开分液漏斗上的活塞,所以正确的操作是打开分液漏斗上的活塞,旋开分液漏斗的旋塞,缓慢滴加。
②由于装置中还残留没有被吸收的SO2和三氧化硫,因此需要继续通一段时间的氧气的目的是使残留在装置中的二氧化硫和三氧化硫被充分吸收;
③D装置增加的质量是三氧化硫的的质量,E中产生的白色沉淀是硫酸钡,则根据S原子守恒可知,SO2的转化率应该是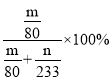 。
。
(3)①SO2具有氧化性,能把硫离子氧化生成单质S沉淀,所以能说明二氧化硫具有氧化性的实验现象为a试管中有淡黄色沉淀生成;
②氯水中含有氯离子,和硝酸银溶液一定生成白色沉淀,方案I不正确;氯水具有强氧化性,能使品红溶液褪色,则方案Ⅱ也不正确;向第三份溶液加入BaCl2溶液,产生白色沉淀,白色沉淀一定是硫酸钡,即SO2被氧化生成硫酸,所以方案Ⅲ合理。反应的离子方程式是Cl2+SO2+2H2O=4H++2Cl-+SO42-。

【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol