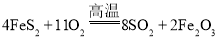题目内容
【题目】CO2常温下是无色无味的气体,无毒,密度比空气大,固态CO2俗称干冰,常用作制冷剂。二氧化碳是绿色植物光合作用不可缺少的原料,温室中常用二氧化碳作肥料。丰富的CO2也可以作为新碳源,用于解决当前应用最广泛的碳源枯竭危机。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例,该过程分两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g) ΔH=-210.5kJ·mol-1
C2H4(g)+2H2O(g) ΔH=-210.5kJ·mol-1
①CO2加氢合成乙烯的热化学方程式为___;
②在一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高CO2的转化率,可以采取的措施是___。(填正确答案标号)
A.减小压强
B.增大H2浓度
C.加入合适的催化剂
D.分离出水蒸气
(2)CO2可用来生产燃料甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1
在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图所示:
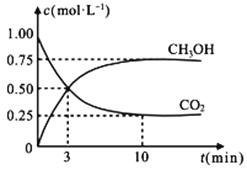
①从反应开始到平衡,氢气的平均反应速率v(H2)=___mol·L-1·min-1;
②下列措施能使平衡体系中![]() 增大的是___;(填正确答案标号)
增大的是___;(填正确答案标号)
A.升高温度
B.充入He(g),使体系压强增大
C.再充入1molH2
D.将H2O(g)从体系中分离出去
③当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c2__c2(填“>”“<”或“=”)。
(3)CO2属于温室气体,可以用碱性溶液进行吸收处理。
①用石灰乳吸收CO2可生成难溶电解质CaCO3,其溶度积常数Ksp=2.8×10-9。现有一物质的量浓度为2×10-2mol·L-1的CaCl2溶液,将其与等体积的纯碱溶液混合(忽略体积变化),则生成沉淀所需纯碱溶液的最小浓度为___mol·L-1;
②利用100mL3mol·L-1的NaOH溶液吸收4.48LCO2(标准状况),得到吸收液。该吸收液中离子浓度由大到小排列的顺序为___,将该吸收液加热蒸干,所得固体的成分是__(填化学式)。
【答案】2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-127.9kJ·mol-1 B 0.225 CD < 5.6×10-7 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) Na2CO3
C2H4(g)+4H2O(g) ΔH=-127.9kJ·mol-1 B 0.225 CD < 5.6×10-7 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) Na2CO3
【解析】
(1)①根据盖斯定律,将第一步反应乘以2再加上第二步反应即得到目标方程式的热化学方程式:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH=-127.9kJ·mol-1;
C2H4(g)+4H2O(g) ΔH=-127.9kJ·mol-1;
②若要加快反应速率,则需要增加反应物浓度或增大压强,若要提高CO2的转化率,则需加入H2或者降低温度,若要符合即加快反应速率有提高CO2的转化率,则需要增加H2的浓度,故选择B;
(2)①反应达平衡时,CO2浓度的减少量为0.75mol/L,故氢气的浓度减少量为2.25mol/L,在此时间内氢气的反应速率v=![]() =0.225mol·L-1·min-1;
=0.225mol·L-1·min-1;
②若要使![]() 得值增大,则需要增加H2的量或者将水从体系中分离出去,故选择CD;
得值增大,则需要增加H2的量或者将水从体系中分离出去,故选择CD;
③反应达平衡后再充入一定量的H2,平衡向右一定,H2量减小,但不能减小到原来的状态,故c1<c2;
(3)①CaCO3的溶度积常数Ksp=c(Ca2+)·c(CO32-)=2.8![]() 10-9,将2
10-9,将2![]() 10-2mol/L CaCl2与未知浓度的纯碱溶液混合得到碳酸钙沉淀,此时溶液中的碳酸根浓度应为
10-2mol/L CaCl2与未知浓度的纯碱溶液混合得到碳酸钙沉淀,此时溶液中的碳酸根浓度应为![]() =2.8
=2.8![]() 10-7mol/L,故需要纯碱溶液的浓度为5.6
10-7mol/L,故需要纯碱溶液的浓度为5.6![]() 10-7mol/L;
10-7mol/L;
②NaOH吸收CO2后,溶液为NaHCO3和Na2CO3的混合溶液,此时溶液中各离子浓度从大到小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);将固体蒸干,原溶液中的碳酸氢根分解为碳酸根,此时固体为碳酸钠固体。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案