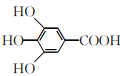
题目内容
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
【答案】D
【解析】
A.依据溴原子半径大于氯原子小于碘原子,原子半径越大,相应的化学键的键能越小分析,所以结合图表中数据可知432 kJ/mol>E(H-Br)>298 kJ/mol,A正确;
B.键能越大,断裂该化学键需要的能量就越大,形成的化学键越稳定,表中键能最大的是H-F,所以最稳定的共价键是H-F键,B正确;
C.氢气变化为氢原子吸热等于氢气中断裂化学键需要的能量,H2→2H(g)△H=+436 kJ/mol,C正确;
D.依据键能计算反应焓变=反应物键能总和-生成物键能总和计算判断,△H=436kJ/mol+157kJ/mol-2×568kJ/mol=-543kJ/mol,H2(g)+F2(g) =2HF(g),△H=-543 kJ/mol ,D错误;
故合理选项是D。

练习册系列答案
相关题目